兴奋性氨基酸转运体家族及其在眼科疾病中的研究进展
阅读量:5969
DOI:10.12419/24070502
发布日期:2024-06-28
作者:
胡晨阳 ,冯砚琳 ,许跃 ,黄晶晶
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
兴奋性氨基酸转运体
谷氨酸
眼科疾病
摘要
谷氨酸是哺乳动物中枢神经系统中的主要兴奋性神经递质,谷氨酸酶系统的持续激活会导致神经元的兴奋性毒性,进而引起神经元损伤和细胞死亡。兴奋性氨基酸转运体家族成员是一种多次跨膜蛋白,位于突触前膜、突触囊泡和神经胶质细胞膜上,也是一种高亲和力的钠钾依赖性载体,能够不断清除细胞外残留的谷氨酸,维持正常的突触内外谷氨酸水平和细胞内氧化还原稳态,对于保护细胞免受兴奋性毒性以及氧化应激损伤至关重要,兴奋性氨基酸转运体家族成员表水平达的失调与多种中枢神经系统疾病神经退行性变的发生和发展密切相关。在视网膜组织中,兴奋性氨基酸转运体家族成员广泛表达。目前大量研究表明,兴奋性氨基酸转运体家族成员广泛参与了青光眼、视网膜缺血再灌注损伤、年龄相关性黄斑变性等眼部疾病的发病,但具体机制有待进一步阐明。为此,文章综述了兴奋性氨基酸转运体家族成员的生理功能及其在相关眼科疾病发生和发展中作用的研究进展,为进一步阐明相关眼病发病的分子机制及新的防治靶点的发现提供新的视角。
全文
文章亮点
1. 关键发现
兴奋性氨基酸转运体家族成员参与了青光眼、视网膜缺血再灌注损伤、年龄相关性黄斑变性等眼部疾病的发病过程。本文总结了兴奋性氨基酸转运体家族成员在相关眼病发病过程中的作用及分子机制。
2. 已知与发现
兴奋性氨基酸转运体家族成员在多种眼部疾病的发生和发展发挥重要作用。
3. 意义与改变
深入探究兴奋性氨基酸转运体家族成员的生理功能及其在相关眼病中的作用对于临床的诊断和治疗意义重大,也为进一步阐明相关眼病发病的分子机制及新防治靶点的发现提供新的视角。
兴奋性氨基酸转运体是中枢神经系统中负责清除细胞外谷氨酸的关键蛋白质,对于维持组织谷氨酸的稳态和正常的神经兴奋水平至关重要。谷氨酸是主要的兴奋性神经递质,但其过量积累会引发兴奋性毒性和氧化应激,导致神经元损伤,谷氨酸水平的异常与多种中枢神经系统退行性疾病的发生密切相关。在视网膜组织中,兴奋性氨基酸转运体家族成员表达的异常导致谷氨酸水平失衡,通过引起神经元持续兴奋和氧化应激水平异常升高等途径导致视网膜结构和功能损伤,参与多种眼科疾病的发病和进展。目前,兴奋性氨基酸转运体在相关眼病中的具体作用机制有待进一步明确,深入探究其在相关眼病发病中的作用和分子机制具有重大的基础研究和临床转化意义,有望为相关疾病的诊断和治疗提供新的靶点。
1 兴奋性氨基酸转运体的研究概况
谷氨酸是哺乳动物中枢神经系统中的主要兴奋性神经递质,它在突触中引发快速的信号传递,基本上介导了所有快速的兴奋性信号。在从突触前神经元释放并经过突触传递后,谷氨酸被突触前神经元重新摄取,或通过膜转运蛋白被邻近的神经胶质细胞吸收。高水平的细胞外谷氨酸浓度过度刺激N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体可以触发神经元死亡级联反应,即所谓的“谷氨酸兴奋性毒性”,这主要是通过大量的细胞内Ca2+内流导致细胞的凋亡和坏死[1-2]。谷氨酸兴奋性毒性与多种神经系统疾病的发病机制有关[3-4]。因此,严格调节细胞外谷氨酸水平对于维持正常的细胞功能意义重大。Na+
依赖的兴奋性氨基酸转运体(excitatory amino acid transporters, EAATs)是中枢神经系统中清除细胞外谷氨酸的主要转运机制。EAATs能够逆浓度梯度将谷氨酸转运至细胞中,维持细胞外低水平的谷氨酸浓度,从而避免谷氨酸水平过高引起的兴奋性毒性。截至目前,已经克隆出五种不同的谷氨酸转运体亚型,分别命名为EAAT1[5]、EAAT2[6]、EAAT3[7]、EAAT4[8]和EAAT5[9]。EAAT1-5转运蛋白在人类及其啮齿类动物同源物谷氨酸天冬氨酸转运体(glutamate-aspartate transporter, GLAST)、胶质细胞谷氨酸转运体-1(glial glutamate transporter-1, GLT-1)、兴奋性氨基酸载体1(excitatory amino acid carrier 1, EAAC1 )、EAAT4和EAAT5分别由SLC1A3、SLC1A2、SLC1A1、SLC1A6和SLC1A7基因编码。EAATs在中枢神经系统中广泛分布,其在细胞外谷氨酸的清除过程中发挥关键作用,因此EAATs在神经系统的谷氨酸水平和兴奋性调控过程中至关重要(图1)[10]。目前,研究证实EAATs家族成员参与多种眼科疾病的发生和发展,国外学者的研究发现,青光眼患者血浆GSH水平降低,视网膜组织EAATs表达下调[11]。敲除GLAST或EAAC1引起小鼠视网膜氧化应激损伤和神经退行性变,被广泛用于正常眼压性青光眼的研究[12-13]。视网膜缺血再灌注损伤引起视网膜组织GLAST和GLT-1表达水平下降,导致谷氨酸堆积,从而引起视网膜结构和功能损伤[14-15]。此外,在年龄相关性黄斑变性患者和模型动物视网膜中均可观察EAATs表达水平的下调[16-17]。这些研究进一步确认了EAATs在眼科疾病中的重要作用,并且探索了其作为潜在治疗靶点的可能性,为了解EAATs在眼科疾病中的角色提供了重要的理论基础。进一步探究EAATs家族成员在眼科疾病中发生作用的分子机制,对于眼科相关疾病发病机制的理解与相关疾病防治意义重大。
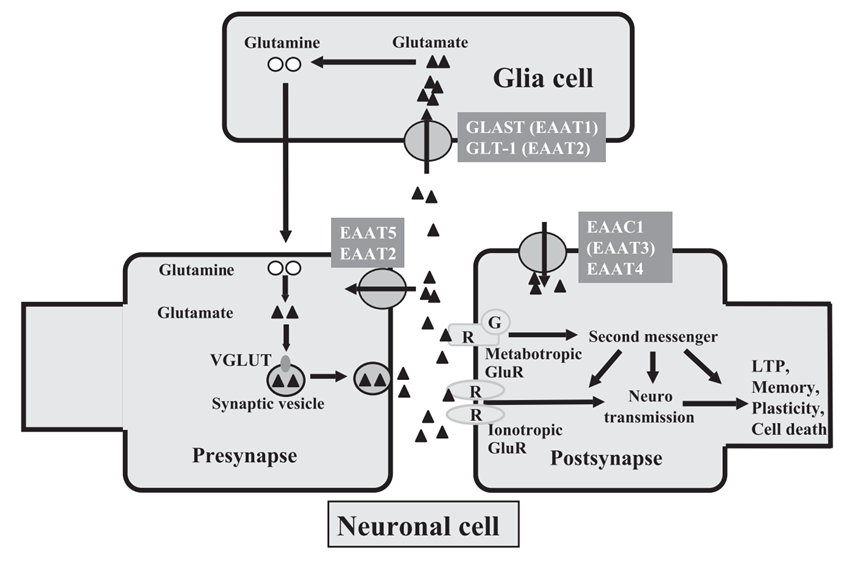
图 1 中枢神经系统谷氨酸传递的机制示意图[10]
Figure 1 Mechanism of glutamate transmission in the central nervous system[10]
2 兴奋性氨基酸转运体家族成员及其生理功能
兴奋性氨基酸转运体是高亲和力的钠钾依赖性载体,位于突触前膜、突触囊泡和神经胶质细胞膜上,对于维持中枢神经系统谷氨酸稳态具有重要意义。细胞外的谷氨酸及Na+ 与奋性氨基酸转运体结合后,谷氨酸顺着Na+ 的浓度梯度与Na+ 一起被转运至细胞内。当谷氨酸和Na+ 进入膜内侧后,谷氨酸被释放入细胞内,K+ 置换Na+ 与兴奋性氨基酸转运体结合,被转运出细胞。随后,Na+ /K+ 泵将细胞内Na+
泵出细胞外,将K+ 泵回细胞内,以维持细胞内外正常的Na+ 、K+ 浓度[18-19]。EAATs家族的部分功能特性可以归因于它们的定位差异。
2.1 EAAT1(GLAST)
EAAT1基因编码一种59 kDa的蛋白质,经过糖基化后形成原生的64 kDa和70 kDa糖蛋白[20]。EAAT1主要表达于星形胶质细胞和少突胶质细胞,虽然EAAT1主要是星形胶质细胞的转运体,但其蛋白也被检测到存在于神经元中[21]。目前认为胶质细胞代谢谷氨酸是控制谷氨酸能神经传递的主要因素[22],谷氨酸从突触前神经元释放后,大部分扩散出突触间隙,并被胶质细胞摄取[23-24]。这意味着胶质细胞中的EAAT1通过防止谷氨酸溢出到相邻突触,从而在控制谷氨酸能的活化水平中起到重要作用[25-26]。沉默EAAT1的表达会提高小鼠大脑中的细胞外谷氨酸水平,并导致兴奋毒性特征的神经退行性变[27]。EAAT1在视网膜组织中的Müller细胞有强烈的表达[27],主要负责视网膜谷氨酸的摄取和清除,维持正常的细胞外谷氨酸水平,防止兴奋性毒性和氧化应激损伤。
2.2 EAAT2(GLT-1)
EAAT2主要表达于星形胶质细胞,在成人脑组织中,EAAT2是主要的星形胶质细胞谷氨酸转运体,负责超过90%的突触谷氨酸清除[28]。在视网膜中,EAAT2与EAAT1负责绝大部分谷氨酸的摄取和清除,维持正常的谷氨酸水平。在星形胶质细胞中,EAAT2水平与谷氨酸脱氢酶活性相关,在突触谷氨酸-谷氨酰胺循环中起关键作用[29]。EAAT2表达的失调与兴奋性毒性、神经元死亡和包括青光眼、阿尔茨海默病、帕金森病、精神分裂症和癫痫在内的多种神经系统疾病相关[30-32]。
2.3 EAAT3(EAAC1)
尽管EAAT3仅负责约1%的谷氨酸摄取,但其在中枢神经系统中普遍表达,主要分布在神经元中,特别是突触后神经元[33]。在大脑组织中,EAAT3的表达对于谷氨酸的清除并没有明显影响[34],尽管不参与谷氨酸浓度梯度的维持,但EAAT3的敲除仍能够引发大鼠的自发性癫痫和行为异常[35]。谷胱甘肽(glutathione, GSH)是由谷氨酸、半胱氨酸和甘氨酸组成的三肽,具有清除活性氧作用,可保护细胞免受氧化应激的伤害。与其他EAATs不同,EAAT3能够将半胱氨酸转运到神经元中用于GSH的合成,调控神经元中的氧化应激水平[36]。敲除EAAT3小鼠的大脑皮层和海马中GSH水平下降、氧化应激水平升高,出现认知功能障碍[37]。视网膜中EAAT3主要表达于视网膜神经节细胞(retinal ganglion cells, RGCs)和无长突细胞,EAAT3敲除引起小鼠RGCs氧化应激水平升高,引起RGCs退行性变,最终导致小鼠视网膜结构和功能的损伤[12]。EAAT3 在调控GSH的合成以及抵抗氧化应激损伤中扮演了重要角色。进一步研究其在不同神经组织中的具体功能以及其在病理生理学中的作用将有助于更好地理解其在神经保护和神经元损伤中的作用。
2.4 EAAT4
EAAT4主要表达于小脑的浦肯野细胞中[38-39],并且集中于树突,尤其是树突棘[38]。浦肯野细胞是小脑皮质的主要神经元和唯一的输出神经元,研究表明,EAAT4表达下调引起小鼠浦肯野细胞动作电位的规律性,并引起小鼠的运动缺陷[40]。目前对于EAAT4在视网膜中生理功能的研究较少,但有研究显示,EAAT4表达于视网膜的星形胶质细胞[41]和视网膜色素上皮细胞[42-43],提示了其在视网膜胶质细胞和神经元中的潜在功能。
2.5 EAAT5
EAAT5几乎只在视网膜的感光细胞和双极细胞中表达。EAAT5在哺乳动物杆状感光细胞轴突末端充当主要的抑制性突触前受体,可以快速结合突触间隙的谷氨酸,并增加杆状感光细胞的敏感度[44-45]。光信号的传导依赖EAAT5转运谷氨酸介导的氯离子电流,抑制EAAT5会引起感光细胞信号传递速度的大幅降低[46],因此抑制EAAT5对从感光细胞到下游视网膜神经元信号的传递具有实质性的影响[47-48]。
3 兴奋性氨基酸转运体与眼部相关疾病
目前,兴奋性氨基酸转运体在各种疾病中的生物学功能受到广泛关注,研究主要集中在中枢神经系统相关神经退行性疾病中。由于兴奋性氨基酸转运体在视网膜组织中表达丰富,近年来越来越多的研究人员开始关注兴奋性氨基酸转运体在眼部相关疾病中的作用,并发现兴奋性氨基酸转运体参与青光眼、视网膜缺血再灌注损伤、年龄相关性黄斑变性等眼部疾病的发生和发展。
3.1 兴奋性氨基酸转运体与青光眼
青光眼是全球范围内第一位的不可逆性致盲性眼病,它是一组以视神经萎缩和视野缺损为共同特征的视神经退行性疾病[49]。在青光眼性神经退行性变的发病机制中,氧化应激损伤、谷氨酸诱导的兴奋性毒性发挥着重大作用[50-51]。有研究发现,青光眼患者的血浆GSH水平降低,与之一致的,谷氨酸转运蛋白在青光眼患者的视网膜组织中表达有所减少[11]。一项研究表明,EphA4/ephrinA3信号通路激活通过抑制PI3K/Akt/NF-κB途径诱导Müller细胞中的GLAST表达下调,从而导致RGCs损伤[52]。在GLAST敲除小鼠中,Müller细胞对谷氨酸的摄取减少导致GSH生成减少,引起小鼠视网膜慢性谷氨酸神经毒性和氧化应激水平升高。另一方面,视网膜中EAAC1的表达主要定位于RGCs,在EAAC1敲除小鼠中,RGCs更容易受到氧化应激损伤的影响,且对小鼠的眼压未产生显著影响,以上病理变化很好地模拟了正常眼压性青光眼神经退行性变的发病过程[12]。因而被广泛用于正常眼压性青光眼的研究,目前已经成为研究正常眼压性青光眼治疗的可靠动物模型,被广泛用于测试正常眼压性青光眼新药和基因治疗的效果。
研究表明,天然化合物石杉碱甲和柚皮素有效抑制小鼠视网膜组织中CMRP2的磷酸化,能够减轻谷氨酸兴奋性毒性并抑制氧化应激从而保护视网膜组织[53]。此外多种新型药物均能通过调控视网膜组织中氧化应激水平,保护GLAST基因敲除引起的视网膜神经退行性变[54-57]。EAAC1敲除诱导的青光眼小鼠模型视网膜中γ-氨基丁酸(gamma-aminobutyric acid, GABA)受体表达水平显著升高,GABA受体拮抗剂能够降低视网膜氧化应激水平[58]。口服坎地沙坦能够抑制EAAC1敲除小鼠视网膜中TLR4和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达,保护视网膜神经节细胞,这也说明了肾素-血管紧张素系统参与了青光眼发病中神经细胞和神经胶质细胞的先天免疫反应[59]。此外溴莫尼定[60]、亚精胺[61]、利帕地尔[62]等药物也能够有效减轻EAAC1敲除引起的视网膜神经元退行性变。笔者课题组发现EAAC1缺失导致小鼠视网膜神经节细胞中氧化应激水平升高,引起细胞凋亡和细胞衰老途径激活以及神经炎症,最终引起小鼠视网膜结构和功能损伤。长期口服褪黑素通过调控NRF2/p53/Sirt1氧化还原敏感信号通路,抑制视网膜神经节细胞凋亡和衰老,进而发挥其神经保护作用[13]。
3.2 兴奋性氨基酸转运体与眼底疾病
视网膜缺血再灌注损伤、年龄相关性黄斑变性等眼底疾病也是重要的不可逆性致盲性眼病。视网膜EAATs的功能障碍通常是导致兴奋性毒性细胞死亡的关键组成部分。研究表明,视网膜缺血再灌注损伤视网膜中GLAST和谷氨酰胺合成酶的表达降低,导致游离谷氨酸浓度的升高,同时视网膜iNOS的磷酸化水平显著升高,中药活血通络利水汤能够显著抑制iNOS的磷酸化,通过减轻凋亡、自噬通路的激活,保护视网膜结构和功能[63]。有研究者发现,大鼠视网膜缺血再灌注损伤后,Müller细胞中GLAST的表达保持稳定,然而GLT-1表达水平显著降低,同时伴随着视网膜组织中谷氨酸水平的升高,说明了兴奋性氨基酸转运蛋白GLT-1在视网膜缺血再灌注损伤后谷氨酸积累中的作用[14-15]。另一项研究发现,在GLAST敲除的小鼠中,视网膜电图b波振幅和振荡电位降低,加剧缺血引起的视网膜损伤,而GLT-1缺陷小鼠的视网膜电图几乎正常,缺血后视网膜损伤轻度增加。这些结果表明,GLAST是光感受器和双极细胞之间正常信号传递所必需的,并且GLAST和GLT-1在视网膜缺血期间都起着神经保护作用[64]。兴奋性氨基酸转运体,尤其是GLAST和GLT-1对于清除视网膜组织中过量的细胞外谷氨酸至关重要,其对于谷氨酸的转运能力容易受到急性缺血性发作的影响,因而干预EAATs的表达和功能可能有希望减轻视网膜缺血再灌注引起的损伤。在年龄相关性黄斑变性动物模型中,视网膜中谷氨酸水平升高,兴奋性氨基酸转运体GLAST的表达下调[16]。也有报道在干性年龄相关性黄斑变性的患者视网膜中,病变区域附近的感光细胞EAAT5表达下调,表明其可能与其发病相关[17]。
4 总结与展望
本文阐述了兴奋性氨基酸转运体在青光眼、视网膜缺血再灌注损伤、年龄相关性黄斑变性等眼科疾病发生和发展中的调控作用。大量研究表明,在青光眼患者和动物模型的视网膜组织中,EAATs表达水平发生显著变化,视网膜缺血再灌注损伤引起视网膜组织GLAST和GLT-1表达水平下降,引起谷氨酸兴奋性毒性和氧化应激损伤,最终导致神经退行性变的发生。此外,在年龄相关性黄斑变性的患者和模型动物视网膜中也观察到EAATs表达水平的下调。一些研究提出兴奋性氨基酸转运体的基因编辑动物可以作为研究青光眼和老年性黄斑变性的实验模型,为相关疾病的治疗提供实验研究基础。EAATs在一些疾病的发生和发展过程中表现出表达水平的变化,虽然EAATs调控这些眼部疾病的分子机制尚有待进一步阐明,但展现出了通过调控其表达有效减轻视网膜损伤,最终保护视功能的巨大潜力,因此很多学者提出,兴奋性氨基酸转运体可能成为治疗眼部相关疾病的新靶点、EAATs在眼部疾病发病过程中作用机制以及调控其表达对于相关眼病的治疗作用是接下来研究的重点。随着对眼部疾病发病机制和EAATs在眼部疾病发病过程中作用机制进一步的探索,兴奋性氨基酸转运体将为眼部疾病的诊断和治疗提供新的视角。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议 ( Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:http://https://creativecommons.org/licenses/by-nc-nd/4.0/。
基金
1. 国家自然科学基金面上项目(82271081)。
This work was supported by General Program of the National Natural Science Foundation of China (82271081).
This work was supported by General Program of the National Natural Science Foundation of China (82271081).
参考文献
1. Olloquequi J, Cornejo-Córdova E, Verdaguer E, et al. Excitotoxicity in
the pathogenesis of neurological and psychiatric disorders: therapeutic
implications[ J]. J Psychopharmacol, 2018, 32(3): 265-275. DOI:
10.1177/0269881118754680.
2. Whetsell WO Jr, Shapira NA. Neuroexcitation, excitotoxicity and
human neurological disease[ J]. LabInvest, 1993, 68(4): 372-387.
3. Crupi R, Impellizzeri D, Cuzzocrea S. Role of metabotropic glutamate
receptors in neurological disorders[ J]. FrontMolNeurosci, 2019, 12:
20. DOI: 10.3389/fnmol.2019.00020.
4. Ribeiro FM, Vieira LB, PiresRGW, et al. Metabotropic glutamate
receptors and neurodegenerative diseases[ J]. PharmacolRes, 2017,
115: 179-191. DOI: 10.1016/j.phrs.2016.11.013.
5. Storck T, Schulte S, Hofmann K, et al. Structure, expression, and
functional analysis of a Na(+)-dependent glutamate/aspartate
transporter from rat brain[ J]. ProcNatlAcadSciUSA, 1992, 89(22):
10955-10959. DOI: 10.1073/pnas.89.22.10955.
6. Pines G, Danbolt NC, Bjørås M, et al. Cloning and expression of a rat
brain L-glutamate transporter[ J]. Nature, 1992, 360(6403): 464-467.
DOI: 10.1038/360464a0
7. Kanai Y, Hediger MA. Primary structure and functional characterization
of a high-affinity glutamate transporter[ J]. Nature, 1992, 360(6403):
467-471. DOI: 10.1038/360467a0.
8. Fairman WA, Vandenberg RJ, Arriza JL, et al. An excitatory aminoacid transporter with properties of a ligand-gated chloride channel[ J].
Nature, 1995, 375(6532): 599-603. DOI: 10.1038/375599a0.
9. Arriza JL, Eliasof S, Kavanaugh MP, et al. Excitatory amino acid
transporter 5, a retinal glutamate transporter coupled to a chloride
conductance[ J]. ProcNatlAcadSciUSA, 1997, 94(8): 4155-4160. DOI:
10.1073/pnas.94.8.4155.
10. Shigeri Y, Seal RP, Shimamoto K. Molecular pharmacology of glutamate
transporters, EAATs and VGLUTs[ J]. Brain Res Brain ResRev, 2004,
45(3): 250-265. DOI: 10.1016/j.brainresrev.2004.04.004.
11. Gherghel D, Griffiths HR , Hilton EJ, et al. Systemic reduction
in glutathione levels occurs in patients with primary open-angle
glaucoma[ J]. InvestOphthalmolVisSci, 2005, 46(3): 877-883. DOI:
10.1167/iovs.04-0777.
12. Harada T, Harada C, Nakamura K, et al. The potential role of glutamate
transporters in the pathogenesis of normal tension glaucoma[ J].
JClinInvest, 2007, 117(7): 1763-1770. DOI: 10.1172/JCI30178.
13. Hu C, Feng Y, Huang G, et al. Melatonin prevents EAAC1 deletioninduced retinal ganglion cell degeneration by inhibiting apoptosis
and senescence[ J]. JPineal Res, 2024, 76(1): e12916. DOI: 10.1111/
jpi.12916.
14. Russo R , Cavaliere F, Varano GP, et al. Impairment of neuronal
glutamate uptake and modulation of the glutamate transporter GLT-1
induced by retinal ischemia[ J]. PLoSOne, 2013, 8(8): e69250. DOI:
10.1371/journal.pone.0069250.
15. Park CK, Cha J, Park SC, et al. Differential expression of two glutamate
transporters, GLAST and GLT-1, in an experimental rat model of
glaucoma[ J]. ExpBrain Res, 2009, 197(2): 101-109. DOI: 10.1007/
s00221-009-1896-0.
16. Telegina DV, Antonenko AK, Fursova AZ, et al. The glutamate/GABA
system in the retina of male rats: effects of aging, neurodegeneration,
and supplementation with melatonin and antioxidant SkQ1[ J].
Biogerontology, 2022, 23(5): 571-585. DOI: 10.1007/s10522-022-
09983-w.
17. Lee A, Stevens MG, Anderson AR, et al. A novel splice variant of the
excitatory amino acid transporter 5: cloning, immunolocalization and functional characterization of hEAAT5v in human retina[ J].
NeurochemInt, 2016: S0197-S0186(16)30404-1. DOI:10.1016/
j.neuint.2016.10.013.
18. Vandenberg RJ, Ryan RM. Mechanisms of glutamate transport[ J].
PhysiolRev, 2013, 93(4): 1621-1657. DOI: 10.1152/physrev.
00007.2013.
19. Zerangue N, Kavanaugh MP. Flux coupling in a neuronal glutamate
transpor ter[ J]. Nature, 1996, 383(6601): 634-637. D OI:
10.1038/383634a0.
20. Conradt M, Storck T, Stoffel W. Localization of N-glycosylation sites
and functional role of the carbohydrate units of GLAST-1, a cloned
rat brain L-glutamate/L-aspartate transporter[ J]. EurJBiochem, 1995,
229(3): 682-687. DOI: 10.1111/j.1432-1033.1995.tb20514.x.
21. Rothstein JD, Martin L, Levey AI, et al. Localization of neuronal and
glial glutamate transporters[ J]. Neuron, 1994, 13(3): 713-725. DOI:
10.1016/0896-6273(94)90038-8.
22. Danbolt NC. Glutamate uptake[ J]. ProgNeurobiol, 2001, 65(1): 1-105.
DOI: 10.1016/s0301-0082(00)00067-8.
23. McLennan H. The autoradiographic localization of L-[3h]glutamate
in rat brain tissue[ J]. Brain Res, 1976, 115(1): 139-144. DOI:
10.1016/0006-8993(76)90828-3.
24. Gundersen V, Shupliakov O, Brodin L, et al. Quantification of
excitatory amino acid uptake at intact glutamatergic synapses by
immunocytochemistry of exogenous D-aspartate[ J]. JNeurosci, 1995,
15(6): 4417-4428. DOI: 10.1523/JNEUROSCI.15-06-04417.1995.
25. Bergles DE, Jahr CE. Synaptic activation of glutamate transporters in
hippocampal astrocytes[ J]. Neuron, 1997, 19(6): 1297-1308. DOI:
10.1016/s0896-6273(00)80420-1.
26. Bergles DE, Dzubay JA, Jahr CE. Glutamate transporter currents
in bergmann glial cells follow the time course of extrasynaptic
glutamate[ J]. ProcNatlAcadSciUSA, 1997, 94(26): 14821-14825.
DOI: 10.1073/pnas.94.26.14821.
27. Robinson MB. The family of sodium-dependent glutamate transporters:
a focus on the GLT-1/EAAT2 subtype[ J]. NeurochemInt, 1998,
33(6): 479-491. DOI: 10.1016/s0197-0186(98)00055-2.
28. Rao P, YallapuMM, Sari Y, et al. Designing novel nanoformulationstargeting glutamate transporter excitatory amino acid transporter 2:
implications in treating drug addiction[ J]. JPersNanomed, 2015, 1(1):
3-9.
29. Kugler P, Schleyer V. Developmental expression of glutamate
transporters and glutamate dehydrogenase in astrocytes of the postnatal
rat hippocampus[ J]. Hippocampus, 2004, 14(8): 975-985. DOI:
10.1002/hipo.20015.
30. Karki P, Smith K, Johnson J Jr, et al. Role of transcription factor Yin
Yang 1 in manganese-induced reduction of astrocytic glutamate transporters: putat ive mechani sm for manganese-induced
neurotoxicity[ J]. NeurochemInt, 2015, 88: 53-59. DOI: 10.1016/
j.neuint.2014.08.002.
31. Takahashi K, Kong Q, Lin Y, et al. Restored glial glutamate transporter
EAAT2 function as a potential therapeutic approach for Alzheimer's
disease[ J]. JExpMed, 2015, 212(3): 319-332. DOI: 10.1084/
jem.20140413.
32. Young D, Fong DM, Lawlor PA, et al. Adenosine kinase, glutamine
synthetase and EAAT2 as gene therapy targets for temporal lobe
epilepsy[ J]. Gene Ther, 2014, 21(12): 1029-1040. DOI: 10.1038/
gt.2014.82.
33. He Y, Janssen WG, Rothstein JD, et al. Differential synaptic localization
of the glutamate transporter EAAC1 and glutamate receptor subunit
GluR2 in the rat hippocampus[ J]. JCompNeurol, 2000, 418(3): 255-
269.
34. Rothstein JD, Dykes-Hoberg M, Pardo CA, et al. Knockout of
glutamate transporters reveals a major role for astroglial transport in
excitotoxicity and clearance of glutamate[ J]. Neuron, 1996, 16(3):
675-686. DOI: 10.1016/s0896-6273(00)80086-0.
35. Sepkuty JP, Cohen AS, Eccles C, et al. A neuronal glutamate
transporter contributes to neurotransmitter GABA synthesis and
epilepsy[ J]. JNeurosci, 2002, 22(15): 6372-6379. DOI: 10.1523/
JNEUROSCI.22-15-06372.2002.
36. Guillet B, Lortet S, Masmejean F, et al. Developmental expression and
activity of high affinity glutamate transporters in rat cortical primary
cultures[ J]. NeurochemInt, 2002, 40(7): 661-671. DOI: 10.1016/
s0197-0186(01)00110-3.
37. Denicola A, Souza JM, Radi R . Diffusion of peroxynitrite across
erythrocyte membranes[ J]. ProcNatlAcadSciUSA, 1998, 95(7): 3566-
3571. DOI: 10.1073/pnas.95.7.3566.
38. Nagao S, Kwak S, Kanazawa I. EAAT4, a glutamate transporter
with properties of a chloride channel, is predominantly localized in
Purkinje cell dendrites, and forms parasagittal compartments in rat
cerebellum[ J]. Neuroscience, 1997, 78(4): 929-933. DOI: 10.1016/
s0306-4522(97)00021-3.
39. Yamada K, Watanabe M, Shibata T, et al. EAAT4 is a post-synaptic
glutamate transporter at Purkinje cell synapses[ J]. Neuroreport, 1996,
7(12): 2013-2017. DOI: 10.1097/00001756-199608120-00032.
40. Perkins EM, Clarkson YL, Suminaite D, et al. Loss of cerebellar
glutamate transporters EAAT4 and GLAST differentially affects
the spontaneous firing pattern and survival of Purkinje cells[ J].
HumMolGenet, 2018, 27(15): 2614-2627. DOI: 10.1093/hmg/
ddy169.
41. Ward MM, Jobling AI, Puthussery T, et al. Localization and expression
of the glutamate transporter, excitatory amino acid transporter 4, within
astrocytes of the rat retina[ J]. Cell Tissue Res, 2004, 315(3): 305-310. DOI: 10.1007/s00441-003-0849-3.
42. Hanna MC, Calkins DJ. Expression of genes encoding glutamate
receptors and transporters in rod and cone bipolar cells of the primate
retina determined by single-cell polymerase chain reaction[ J]. MolVis,
2007, 13: 2194-2208.
43. Pignataro L, Sitaramayya A, Finnemann SC, et al. Nonsynaptic
locali zat ion of the exc itator y amino ac id transpor ter 4 in
photoreceptors[ J]. MolCellNeurosci, 2005, 28(3): 440-451. DOI:
10.1016/j.mcn.2004.10.004.
44. Wersinger E, Schwab Y, Sahel JA, et al. The glutamate transporter
EAAT5 works as a presynaptic receptor in mouse rod bipolar
cells[ J]. JPhysiol, 2006, 577(Pt 1): 221-234. DOI: 10.1113/jphysiol.
2006.118281.
45. Thoreson WB, Chhunchha B. E A AT5 glutamate transporter
rapidly binds glutamate w ith micromolar aff inity in mouse
rods[ J]. JGenPhysiol, 2023, 155(9): e202313349. DOI: 10.1085/
jgp.202313349.
46. Tang FS, Yuan HL, Liu JB, et al. Glutamate transporters EAAT2
and EAAT5 differentially shape synaptic transmission from rod
bipolar cell terminals[ J]. eNeuro, 2022, 9(3): ENEURO.0074-
ENEURO.0022.2022. DOI: 10.1523/ENEURO.0074-22.2022.
47. Lukasiewcz PD, Bligard GW, DeBrecht JD. EAAT5 glutamate
transporter-mediated inhibition in the vertebrate retina[ J].
FrontCellNeurosci, 2021, 15: 662859. DOI: 10.3389/fncel.2021.
662859.
48. Bligard GW, DeBrecht J, Smith RG, et al. Light-evoked glutamate
transporter EAAT5 activation coordinates with conventional feedback
inhibition to control rod bipolar cell output[ J]. JNeurophysiol, 2020,
123(5): 1828-1837. DOI: 10.1152/jn.00527.2019.
49. Jonas J, Aung T, Bourne R, et al. Glaucoma[ J]. Lancet, 2017, 390:
2183-2193. DOI: 10.1016/S0140-6736(17)31469-1.
50. Jassim AH, Fan Y, Pappenhagen N, et al. Oxidative stress and
hypoxia modify mitochondrial homeostasis during glaucoma[ J].
AntioxidRedox Signal, 2021, 35(16): 1341-1357. DOI: 10.1089/
ars.2020.8180.
51. Di Pierdomenico J, Gallego-Ortega A , Norte-Muñoz M, et al.
Evaluation of the neuroprotective efficacy of the gramine derivative
ITH12657 against NMDA-induced excitotox icity in the rat
retina[ J]. FrontNeuroanat, 2024, 18: 1335176. DOI: 10.3389/
fnana.2024.1335176.
52. Zhou ZX, Xu LJ, Wang HN, et al. EphA4/ephrinA3 reverse signaling
mediated downregulation of glutamate transporter GLAST in Müller
cells in an experimental glaucoma model[ J]. Glia, 2023, 71(3): 720-
741. DOI: 10.1002/glia.24307.
53. Wang Y, Brahma MM, Takahashi K, et al. Drug treatment attenuates
retinal ganglion cell death by inhibiting collapsinresponse mediator protein 2 phosphorylation in mouse models of normal tension
glaucoma[ J]. NeuromolecularMed, 2024, 26(1): 13. DOI: 10.1007/
s12017-024-08778-1.
54. Sano H, Namekata K , Kimura A , et al. Differential effects of
N-acetylcysteine on retinal degeneration in two mouse models of
normal tension glaucoma[ J]. Cell Death Dis, 2019, 10(2): 75. DOI:
10.1038/s41419-019-1365-z.
55. Nakano N, Ikeda HO, Hasegawa T, et al. Neuroprotective effects of
VCP modulators in mouse models of glaucoma[ J]. Heliyon, 2016,
2(4): e00096. DOI: 10.1016/j.heliyon.2016.e00096.
56. Kimura A, Guo X, Noro T, et al. Valproic acid prevents retinal
degeneration in a murine model of normal tension glaucoma[ J].
NeurosciLett, 2015, 588: 108-113. DOI: 10.1016/j.neulet.
2014.12.054.
57. Namekata K, Harada C, Kohyama K, et al. Interleukin-1 stimulates
glutamate uptake in glial cells by accelerating membrane trafficking of
Na+/K+-ATPase via actin depolymerization[ J]. MolCellBiol, 2008,
28(10): 3273-3280. DOI: 10.1128/MCB.02159-07.
58. Okumichi H, Mizukami M, Kiuchi Y, et al. GABA A receptors are
associated with retinal ganglion cell death induced by oxidative
stress[ J]. ExpEye Res, 2008, 86(5): 727-733. DOI: 10.1016/
j.exer.2008.01.019.
59. Semba K, Namekata K, Guo X, et al. Renin-angiotensin system
regulates neurodegeneration in a mouse model of normal tension
glaucoma[ J]. Cell Death Dis, 2014, 5(7): e1333. DOI: 10.1038/
cddis.2014.296.
60. Semba K , Namekata K , Kimura A, et al. Brimonidine prevents
neurodegeneration in a mouse model of normal tension glaucoma[ J].
Cell Death Dis, 2014, 5(7): e1341. DOI: 10.1038/cddis.2014.306.
61. Noro T, Namekata K , Azuchi Y, et al. Spermidine ameliorates
neurodegeneration in a mouse model of normal tension glaucoma[ J].
InvestOphthalmolVisSci, 2015, 56(8): 5012-5019. DOI: 10.1167/
iovs.15-17142.
62. Akaiwa K, Namekata K, Azuchi Y, et al. Topical ripasudilsuppresses
retinal ganglion cell death in a mouse model of normal tension
glaucoma[ J]. InvestOphthalmolVisSci, 2018, 59(5): 2080-2089. DOI:
10.1167/iovs.17-23276.
63. Han L, Zhang M, Yang Z, et al. Huoxue-Tongluo-Lishui-Decoction
is visual-protective against retinal ischemia-reperfusion injury[ J].
BiomedecinePharmacother, 2020, 125: 109998. DOI: 10.1016/
j.biopha.2020.109998.
64. Harada T, Harada C, Watanabe M, et al. Functions of the two glutamate
transporters GLAST and GLT-1 in the retina[ J]. ProcNatlAcadSciUSA,
1998, 95(8): 4663-4666. DOI: 10.1073/pnas.95.8.4663.