VEGF、IL-6 的水平与糖尿病视网膜病变关系的研究
关键词
摘要
目的:检测 2 型糖尿病患者眼房水中血管内皮生长因子(Vascular endothelial growth factor, VEGF)和白细胞介素-6(Interleukin-6, IL-6)的含量,并探讨其临床意义
方法:在白内障手术过程中获取 66 例 2 型糖尿病患者的房水,采用双抗体夹心酶联免疫吸附(ELISA)法测定 VEGF 和 IL-6 的含量。根据手术后散瞳眼底检查和眼底荧光素血管造影检查确定糖尿病视网膜病变的分期。实验组分为:无糖尿病视网膜病变组(NDR)21 例、单纯型糖尿病性视网膜病变组(BDR)26 例、增生型糖尿病性视网膜病变组(PDR)19 例,正常对照组为健康的老年性白内障患者 20 例。
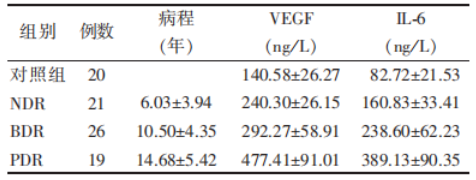
结果:NDR 组、BDR 组、PDR 组的房水 VEGF 含量分别为(240.30 ± 26.15)pg/ml、(292.27 ± 58.91)pg/ml、(477.41 ± 91.01)pg/ml,IL-6 含量分别为(160.83 ± 33.41)pg/ml、(238.60 ± 62.23)pg/ml、(389.13 ± 90.35)pg/ml,对照组房水 VEGF 含量为(140.58 ± 26.27)pg/ml、IL-6 含量为(82.72 ± 21.53)pg/ml,对照组与实验组比较差异均有统计学意义(F = 113.67,P < 0.01;F = 106.53,P < 0.01)。实验组房水中的 VEGF 与 IL-6 含量有相关性(r = 0.995,P < 0.01);糖尿病患者的病程与房水中 VEGF(r = 0.792,0.826,0.841 均 P < 0.01)、IL-6(r = 0.829,0.817,0.896 均 P < 0.01)含量有相关性。
结论:VEGF、IL-6 在糖尿病视网膜病变的形成过程中有重要作用,且两者之间有相关性。
全文
糖尿病视网膜病变(Diabetic retinopathy, DR)是糖尿病常见和严重的并发症之一,也是目前主要致盲原因之一。长期以来,学者们对 DR 的发病机理进行了大量研究,目前认为,DR 在病理学上属于一种细胞增殖性疾病,因此其发生、发展必然与细胞增殖的调控失常有关。细胞因子在细胞增殖的调控中起重要作用,它们可能参与了视网膜增殖病变的发生、发展过程。血管内皮生长因子(Vascular endothelial growth factor, VEGF)是目前已知最强的内皮细胞选择性促有丝分裂因子和血管生成因子,能特异性刺激血管内皮细胞增殖,参与新生血管的形成过程,被认为是与 DR 新生血管形成联系最紧密的一个细胞因子。除此之外,其他细胞因子可能也在 DR 的病理过程中起着重要作用,白细胞介素-6(Interleukin-6, IL-6)属于炎症前细胞因子(Proinflammatory cytokine),是活化的 T 细胞、单核巨噬细胞、纤维母细胞及某些肿瘤细胞所分泌的一种蛋白分子,是感染或外伤急性期反应的主要诱导因子。Yuuki 等 [1] 研究表明 IL-6 在 DR 的病理过程中起重要作用。本研究测定糖尿病患者房水中 VEGF、IL-6 的含量,以探讨两者与 DR 发生、发展的关系。
对象和方法
一、研究对象
二、方法
1. 房水取样方法:开睑后,以 0.5 g/L 碘伏稀释液消毒结膜囊,无菌生理盐水反复冲洗,无菌纱布吸尽结膜囊中积液,以无菌 1 ml 一次性塑料 TB 针管接 9 号针头,于角膜缘内 1 mm 前房穿刺,在 2 ~ 5 s 内从中央瞳孔区抽吸,不触及虹膜、晶状体及角膜内皮细胞,采集房水约 0.2 ml,即移至已消毒并硅化的 0.5 ml Eppendorf 管,放入液氮中,然后存放于 -70 ~ -80℃ 冰箱中待分析。三、统计学分析
结果
一、一般结果
二、房水中 VEGF 和 IL-6 的含量
三、糖尿病病程、眼底病变程度以及与房水中 VEGF、IL-6 含量的关系
表 1 糖尿病患者病程、房水中 VEGF、IL-6 的含量
讨论
房水是一种包含多种生长因子的复合的生物活性液体,眼内组织产生的各种生长因子可通过多种途径进入前房 [8],房水中生长因子的浓度变化可在一定程度上反映它们在眼内组织的表达情况。本研究结果表明,实验组房水 VEGF 含量均比对照组高,差异有统计学意义,且 NDR 组、BDR 组、PDR 组的房水 VEGF 含量有明显增加的趋势,即房水中 VEGF 含量越高,DR 程度越重。
IL-6 是一种典型的具有多种生物学功能的细胞因子,主要由单核-吞噬细胞、血管内皮细胞、成纤维细胞产生;受糖皮质激素、雌激素和环孢霉素 A 的抑制;人免疫缺陷病毒也能诱导单核细胞产生 IL-6;IL-10 和 IL-13 能抑制单核细胞产生 IL-6;IL-6 也有自分泌和旁分泌效应 [9]。IL-6 主要生物学作用是促进 B 细胞增殖分化和分泌抗体;在 IL-2 存在下,IL-6 可促使成熟和未成熟 T 细胞分化为细胞毒 T 淋巴细胞;促进肝合成急性期蛋白;作为内源性致热原,参与炎症反应;对神经组织和造血系统具有广泛效应。
IL-6 是体内炎症反应和一系列病理生理过程的重要介素。在糖尿病视网膜病变条件下,由于高血糖所致的线粒体活性氧生成增多,内皮细胞和周细胞发生凋亡,同时 NO 扩张血管使得血流量增大,造成对内皮细胞的机械性损害,这使得视网膜微血管逐渐出现粘滞度增高。在活性氧诱导的白细胞介素(IL-1、IL-6)等作用下,细胞黏附分子(ICAM-1、VCAM-1)的表达上调,白细胞黏附使内皮细胞进一步受损。IL-6 可作为急性反应的始发因子,能影响 2 型糖尿病的发病,并通过与胰岛素的相互作用而影响 2 型糖尿病的发病。孙纳等 [10] 以胚胎胰岛研究证明,糖刺激可以明显促进胰岛细胞分泌白细胞介素-6,糖尿病患者普遍存在的高血糖可促进 IL-6 的生成。有报道 [11],大量的 IL-6 可对胰岛细胞产生直接的细胞毒作用,从而加速糖尿病的发生。糖尿病时血液中的高血糖可刺激血管内皮细胞和外周血单核细胞 IL-6 分泌,同时,IL-6 可促进 T、B 细胞过度激活和扩增,加速成细胞凋亡,促进胰岛 β 细胞的破坏 [12],加重糖尿病的病程。顾永辉等 [13] 研究发现,2 型糖尿病患者体内存在较高的 IL-6,经降糖药物治疗控制血糖后,患者血清 IL-6 水平显著降低。
糖化蛋白终末产物是糖尿病性视网膜病变发生、发展的一个重要原因。近年来研究发现,糖化蛋白终末产物可通过与多种细胞表面的 AGE 受体结合激活免疫细胞,刺激人外周血淋巴细胞分泌 IL-6 [14],糖尿病患者表现出的糖化蛋白终末产物诱导细胞因子分泌的高敏现象有可能是糖尿病并发症发生的一个因素。闫晓光等 [15] 研究发现,糖尿病患者血清 IL-6 水平增高,随着糖尿病性视网膜病变程度的加重,IL-6 水平逐渐升高,提示其与糖尿病性视网膜病变,特别是增殖性糖尿病视网膜病变的发生、发展有关。有研究表明,IL-6 在玻璃体内浓度升高与增殖性玻璃体视网膜病变(PVR)的发病过程密切相关 [1]。
本研究结果表明,实验组房水中 IL-6 含量均比对照组高,NDR 组、BDR 组、PDR 组的房水 IL-6 含量有明显增加的趋势,随着糖尿病病程的延长,眼部病情的加重,房水中的 IL-6 含量是增高的,提示 IL-6 与 DR 的发生、发展有着密切的联系。IL-6 是 T 淋巴细胞、B 淋巴细胞、单核细胞等分泌的多功能细胞因子,具有广泛的生物活性。有作者提出 IL-6 等细胞因子同样由低氧所诱导,与 VEGF 具有某些类似的特征,也可作为新生血管因子起作用 [16]。更重要的是,IL-6 可直接诱导 VEGF 的表达,这一效应通过 VEGF 基因启动子上特异性 DNA 序列及 5' 非翻译区(5' UTR)的特异元件所介导。由此我们可以推测,在视网膜低氧条件下,局部微环境的改变诱导了 VEGF 和 IL-6 的产生,而 IL-6 又可促进 VEGF 的表达增加,两者共同作用导致视网膜新生血管生成 [17]。本研究结果亦表明,房水中 VEGF 和 IL-6 含量之间存在密切的相关性,这进一步支持了 IL-6 在糖尿病视网膜病变中的重要作用。
结论
本研究结果表明,房水中 VEGF 和 IL-6 的含量在糖尿病视网膜病变患者中显著升高,并且随着病程的延长,房水中这两种因子的含量呈现出逐渐增加的趋势。这提示 VEGF 和 IL-6 可能在糖尿病视网膜病变的发生与发展中发挥重要作用。因此,监测房水中 VEGF 和 IL-6 的水平可能有助于评估糖尿病视网膜病变的严重程度,并为临床治疗提供参考。