血糖变异性对糖尿病视网膜病变的影响及研究进展
阅读量:5350
DOI:10.12419/24103106
发布日期:2025-02-28
作者:
顾赵赵 ,罗雨馨 ,俞莹
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
血糖变异性
糖尿病视网膜病变
糖尿病
摘要
糖尿病视网膜病变(diabetic retinopathy, DR)作为糖尿病的一种常见并发症是导致工作年龄人群失明的主要原因。血糖变异性(glycemic variability, GV)指血糖波动的程度。最新研究表明,GV与糖尿病患者的代谢状况和微血管病变密切相关。该文综述了GV对DR的影响及其研究进展。GV是指血糖水平在高点和低点之间波动的不稳定状态,分为长期GV和短期GV。长期GV主要通过空腹血糖(fasting plasma glucose, FPG)、餐后血糖(postprandial plasma glucose, PPG)和糖化血红蛋白(glycated hemoglobin, HbA1c)评估,短期GV则通过血糖标准差(standard deviation, SD)、变异系数(coefficient of variation, CV)、低血糖指数(low blood glucose index, LBGI)等指标量化。研究表明,GV是糖尿病大管和微血管并发症的重要风险预测因子,与冠状动脉综合征、心肌梗死、脑卒中、糖尿病肾病、周围神经病变等密切相关。在DR方面,GV可能是其进展的风险因素,高GV会加剧氧化应激、炎症反应、内皮功能障碍和新生血管生成,从而促进DR的发展。治疗策略包括动态血糖监测系统、药物干预(如基础胰岛素、阿格列汀等)、合理饮食和运动等,这些方法可改善GV,降低并发症风险,提高患者预后和生活质量。
全文
文章亮点
1. 关键发现
• 血糖变异性反映了患者动态的血糖波动变化,是血糖监测的新指标,比常规血糖参数更能反映出血糖对机体的影响,是糖尿病及其并发症风险评估的重要指标。本文总结了血糖变异性的评价指标及其对糖尿病相关并发症尤其是糖尿病视网膜病变的影响。2. 已知与发现
• 糖尿病视网膜病变是糖尿病最常见的并发症之一,其发展与许多危险因素有关,但此前的研究大多集中于高血糖对糖尿病视网膜病变的影响。• 本文总结了血糖变异性的相关评价指标,强调了血糖波动对糖尿病相关并发症的影响,尤其是对糖尿病视网膜病变的作用及其可能的机制。血糖波动可能通过诱导氧化应激、炎症、内皮功能障碍和新生血管生成等影响糖尿病视网膜病变的进展。调节饮食或生活方式,使用新型降糖药物或新型长效胰岛素,应用新型血糖监测技术可以改善血糖变异性。
3. 意义与改变
• 深入认识血糖变异性,有助于更有效地进行血糖管理,减轻糖尿病患者的症状,降低并发症的风险并改善其生活质量。糖尿病(diabetes mellitus, DM)是由于胰岛素分泌不足、胰岛素抵抗或两者共同作用引起的代谢性疾病,可造成肾脏、心脏、眼等多种器官的损伤、功能障碍和衰竭[1]。糖尿病视网膜病变(diabetic retinopathy, DR)是一种常见的糖尿病微血管并发症,是致使工作年龄人群可预防性失明的主要原因之一。近期多项研究表明,血糖变异性(glycemic variability, GV)即血糖波动的程度,与机体的代谢状况及微血管病变显著相关,减轻血糖变异的程度可以防止微血管病变的发生和发展[2-3]。此外,GV还是糖尿病患者大血管并发症的重要风险预测因子,包括冠状动脉综合征、心肌梗死和心律失常等[4]。因此,GV是糖尿病管理中的一个关键参数,对预测和防治糖尿病并发症具有重要作用。本文就GV对DR的影响及研究进展做一综述,以期为DR的防治提供新的思路。
1 GV的定义和相关指标
GV是指血糖水平在其高点和低点之间波动的不稳定状态,依据时间长短主要分为长期GV和短期GV,其中短期GV包括日内和日间GV[5]。一般认为,狭义的GV即为一日内的血糖波动,包括高血糖和低血糖的间歇性发作,其特征是在一天内由动态葡萄糖监测系统测量的葡萄糖偏离稳态的幅度、频率和持续时间[6-7]。虽然目前GV的评估还没有统一的金标准,但最新研究表明一些综合性的指标可作为GV的有效评估手段。长期GV的评估主要依据系统性的测定值,包括空腹血糖(fasting plasma glucose, FPG)、餐后血糖(postprandial plasma glucose, PPG)和糖化血红蛋白(glycated hemoglobin, HbA1c)等[8]:1)FPG,至少禁食8~10 h后测量,反映胰岛B细胞功能;2)PPG,餐后2 h血糖,对早期诊断糖尿病和预防并发症重要;3)HbA1c,反映过去2~3个月的平均血糖水平,是糖尿病控制的关键指标。
短期GV的评估侧重于血糖波动的量化指标,如血糖标准差(standard deviation, SD)、血糖变异系数(coefficient of variation, CV)、低血糖指数(low blood glucose index, LBGI)、高血糖指数(high blood glucose index, HBGI)、血糖振幅的平均幅度(mean amplitude of glycemic excursions, MAGE)、日均差值(mean of daily differences, MODD)和血糖达标时间百分比(time in range, TIR)。常用的指标:1)血糖SD可以直接评估血糖波动幅度[9];2)血糖CV是SD除以平均血糖,反映低血糖风险,CV ≥ 36%为高GV[10];3)LBGI是预测低血糖风险的指标[11];4)MAGE对血糖的大幅度波动很敏感,但不能准确评估血糖变化的速度[12];5)MODD为连续2 d同一时间血糖绝对差值的平均值,主要用于评估不同的治疗方案的可预测性[11],是目前公认的评价日间GV的指标;6)TIR,是指患者在24 h内,血糖值处于目标范围内时间所占的百分比,控制目标>70%[13]。
2 GV对糖尿病眼外并发症的影响
GV是糖尿病患者大血管并发症如冠状动脉综合征、心律失常、脑卒中等的重要风险预测因子[14]。有研究表明血糖波动可以促进巨噬细胞对内皮的黏附,加快动脉粥样硬化斑块的形成,增加2型糖尿病(type 2 diabetes mellitus, T2DM)患者发生急性冠脉综合征(acute coronary syndrome, ACS)的风险[15]。在糖尿病并发急性心肌梗死(acute myocardial infarction, AMI)的患者中,高GV促进心肌缺血坏死和梗死区室壁损伤,增加心肌再灌注后的最终梗死面积,在慢性期还会促进左心室心肌肥厚[16]。有研究证实,T2DM并发ACS住院患者中,GV较高者的非致命性心肌梗死和心力衰竭发生率比GV较低的患者高57%,心房颤动的发生率增加了62.9%[17]。此外,GV对心律失常的影响还与年龄有关,高GV会增加老年糖尿病患者发生房性期前收缩、房性心动过速和室性早搏的概率[18]。高GV还会增加脑卒中发生的风险,高GV就意味着出现间歇性低血糖的风险更大,研究发现,强化治疗组(血糖80~130 mg/dL)与标准治疗组(血糖80~179 mg /dL)相比,强化治疗组有更多的严重低血糖发作(血糖< 40 mg/dL),同时强化治疗组出血性脑卒中的风险增加了31%[19]。糖尿病的微血管并发症包括DR、糖尿病肾病和周围神经病变等[20-21]。糖尿病肾病现已是发达国家终末期肾病的主要原因之一。有研究通过检测HbA1c和平均空腹血糖的变化来预测糖尿病肾病,HbA1c变化率大于13.44%的患者发生糖尿病肾病的风险增加1.58倍,空腹血糖变化率大于15.99%时风险提高4.75倍,这表明,血糖波动水平可显著影响早期糖尿病肾病的进展[22]。
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病常见的慢性并发症,DPN可能引起神经痛、足部损伤甚至坏疽,这对患者的日常生活质量构成了重大影响。有证据表明GV是1型糖尿病(type 1 diabetes mellitus, T1DM)患者并发DPN的危险因素[23]。研究发现,GV的重要指标MAGE与运动和感觉轴突功能改变的兴奋性参数,如7 ms时的超兴奋性、最小I/V斜率等密切相关,提示GV不仅是轴突兴奋性改变的关键影响因素,也是DPN发生、发展的一个促进因素[24]。
此外,另一种糖尿病微血管并发症心脏自主神经病变(cardiac autonomic neuropathy, CAN)也与GV相关,严重低血糖的时间是CAN的独立预测因子[25]。较高的SD与更严重的CAN和站立反应时的严重收缩压下降相关,表明GV在交感神经功能障碍中起作用[26]。
3 GV对DR的影响和机制
DR是常见的糖尿病微血管并发症,是20~74岁人群可预防性失明的主要原因之一[27]。目前,DR的全球患病率仍然很高,每10例DM患者中就有2例DR患者,特别是在低收入和中等收入国家,预计全球DR人数在2045年将达到7亿[28]。DR分为2个阶段:非增殖性DR和增殖性DR(proliferative diabetic retinopathy, PDR)。在PDR阶段,可能会引发糖尿病性黄斑水肿、玻璃体积血和牵引性视网膜脱离等严重并发症,从而引起视力严重下降甚至失明。近期研究表明,GV可能是DR进展的一个风险因素。有研究发现HbA1c的SD与早期DR相关[29],血糖控制良好(HbA1c≤7.5%)的患者,HbA1c和空腹血糖的标准差和变异系数可用于评估DR的进展[30],GV越高,非增殖性DR的进展越快,进展为PDR的风险就越高[31]。
血糖振幅的平均幅度MAGE,是多个相邻血糖最高值与最低值之间的差值的平均值。它对血糖的大幅度波动很敏感,但不能准确评估血糖变化的速度[12]。
高MAGE会加剧氧化应激,促进内皮细胞的凋亡损伤[32]。MAGE的升高能促进炎症因子(如IL-6和TNF-α)的产生,加剧糖尿病患者微血管病变的发生和发展[33]。Costantino等[34]发现,血糖平均振幅MAGE与p66Shc(线粒体氧化应激的关键驱动因子)启动子的表观遗传谱改变相关,p66Shc的过度表达会导致持续的氧化应激,导致内皮细胞损伤。血小板的聚集和活化与HbA1c和MAGE的大小密切相关,研究表明,血管内皮损伤标志物(E-se-lectin和vWF)和血小板活化指标(PAG、CD62p)均与MAGE呈显著正相关,表明MAGE的增加会加剧内皮损伤、血小板活化,促进DR的发展[35]。
血糖的SD是评估GV的最直接的指标,用于评估血糖波动的幅度。比如血糖从50 mg/dL波动到100 mg/dL和从100 mg/dL波动到150 mg/dL的SD是相同的但在临床上前者的波动幅度显然要比后者更有意义[9]。Piconi等[36]通过用间歇高血糖刺激内皮细胞模拟血糖SD的波动,发现血糖SD的波动通过诱导过量的ROS激活蛋白激酶C(protein kinase C, PKC),进一步激活己糖胺和多元醇途径,促进晚期糖基化终产物(advanced glycation end-products, AGEs)的产生,从而促进胰岛素抵抗、胰岛素分泌受损,并加剧内皮细胞功能障碍。Quagliaro等[37]通过间歇高糖培养内皮细胞,发现血糖波动通过激活PKC进一步促进烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase)的产生,释放过量的活性氧导致内皮细胞损伤增加。Costantino等[34]发现,PKC也是连接蛋白p66Shc的主要调节因子,连接蛋白p66Shc是糖尿病中线粒体氧化应激和血管损伤的关键驱动因素,会加剧内皮损伤。Guo等[38]通过间歇性低糖刺激内皮细胞模拟血糖急性波动,发现血糖SD波动的增大会促进缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)的产生。视网膜新生血管形成是PDR的主要病理特征,HIF-1α作为一种重要的转录调控因子,在其中起着至关重要的作用[39]。HIF-1α的增加会导致HIF依赖性血管生成介质表达增加,从而促进视网膜新生血管生成[39]。Picconi等[40]通过交替低糖和高糖培养Müller细胞来模拟血糖波动,发现血糖SD的快速变化可以导致Müller细胞功能障碍,胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)和水通道蛋白(aquaporin, AQP)水平升高,特别是适应了高糖的Müller细胞转变为低糖刺激后出现细胞死亡增加,约增加了细胞总数的15%。
低血糖指数LBGI,是衡量血糖降至预定范围以下时GV的指标,其计算公式为:
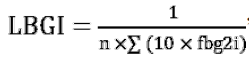
4 GV的治疗策略
在糖尿病患者的慢病管理中,最常用的是患者的自我血糖监测,但次数多、夜间监测困难等往往会影响血糖的监测效果及实施。动态血糖监测系统是目前最先进、最成熟的血糖监测技术,可以在日常生活状态下持续、动态地观察血糖的实时变化,从而进行更好的血糖管理,为治疗决策提供信息,并可以及时调整治疗方案[42]。研究发现,实时动态血糖监测和连续扫描血糖监测能够改善T1DM个体的短期和长期血糖控制,增加T1DM和T2DM成人的血糖达标时间百分比TIR并改善GV[43-45],降低HbA1c水平[46]。动态血糖监测还有利于降低接受胰岛素治疗的T2DM患者的GV并增加血糖达标时间百分比TIR的稳定性(+6.36%)[47]。药物是改善GV最主要的手段。有研究表明与预混胰岛素相比,基础胰岛素可降低T2DM的血糖变异性和间歇性低血糖发生风险[48]。德谷胰岛素和甘精胰岛素比中效胰岛素更有助于改善T1DM幼儿和学龄前儿童的HbA1c和TIR,降低间歇性低血糖发生风险[49]。阿格列汀在改善T2DM患者的MAGE和TIR方面具有显著的效果[50]。Takuma等[51]的一项研究发现,西格列汀在改善T2DM和较低身体质量指数患者的TIR方面具有优势,而达格列净在实现较高身体质量指数患者的TIR方面具有优势。
除了药物干预,合理的饮食和运动也能够帮助改善血糖波动[52]。一项临床试验证明,低碳水化合物早餐(如鸡蛋、鲜奶油、干酪等)可显著改善T2DM患者的GV [53]。另一项临床研究表明,有氧运动和阻力运动相结合的训练可以降低血糖的SD和CV,改善糖尿病患者的血糖波动[54],有利于更好地控制血糖,改善脂质代谢,促进心肺健康。
5 结论
综上所述,GV是糖尿病及其并发症重要的风险预测指标。血糖波动通过诱导氧化应激、炎症反应、内皮功能障碍和促进新生血管生成等途径影响DR的发展。应用新兴的血糖监测技术,结合新型药物、调整饮食和运动,能够改善血糖波动,降低糖尿病相关并发症的风险并提高临床治疗效果,改善患者的预后和生活质量。利益冲突
所有作者均声明不存在利益冲突。开放获取声明
本文适用于知识共享许可协议 (Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。基金
1. 江苏省医学重点学科( JSDW202245);南通市基础科学研究和社会民生科技计划项目
(MSZ2022024)。
This work was supported by Jiangsu Provincial Key Medical Discipline ( JSDW202245); Nantong City Basic Scientific Research and Social Livelihood Science & Technology Program (MSZ2022024).
This work was supported by Jiangsu Provincial Key Medical Discipline ( JSDW202245); Nantong City Basic Scientific Research and Social Livelihood Science & Technology Program (MSZ2022024).
参考文献
1. Association AD. Diagnosis and classification of diabetes mellitus[ J].
Diabetes Care, 2009, 32(Suppl 1): S62-S67. DOI:10.2337/dc09-S062.
2. Hsieh YT, Hsieh MC. Fasting plasma glucose variability is an
independent risk factor for diabetic retinopathy and diabetic macular
oedema in type 2 diabetes: an 8-year prospective cohort study[ J]. Clin
Exp Ophthalmol, 2020, 48(4): 470-476. DOI:10.1111/ceo.13728.
3. Hsing SC, Lin C, Chen JT, et al. Glycemic gap as a useful surrogate
marker for glucose var iabi lit y and progression of diabetic
retinopathy[ J]. J Pers Med, 2021, 11(8): 799. DOI:10.3390/
jpm11080799.
4. Martinez M, Santamarina J, Pavesi A, et al. Glycemic variability
and cardiovascular disease in patients with type 2 diabetes[ J]. BMJ
Open Diabetes Res Care, 2021, 9(1): e002032. DOI:10.1136/
bmjdrc-2020-002032.
5. Belli M, Bellia A, Sergi D, et al. Glucose variability: a new risk factor for
cardiovascular disease[ J]. Acta Diabetol, 2023, 60(10): 1291-1299.
DOI:10.1007/s00592-023-02097-w.
6. Breyton AE, Lambert-Porcheron S, Laville M, et al. CGMS and
glycemic variability, relevance in clinical research to evaluate
interventions in T2D, a literature review[ J]. Front Endocrinol, 2021,
12: 666008. DOI:10.3389/fendo.2021.666008.
7. Pinto MV, Rosa LF, Pinto LF, et al. HbA1c variability and long-term
glycemic control are linked to peripheral neuropathy in patients with
type 1 diabetes[ J]. Diabetol Metab Syndr, 2020, 12: 85. DOI:10.1186/
s13098-020-00594-4.
8. Zhou Z, Sun B, Huang S, et al. Glycemic variability: adverse clinical
outcomes and how to improve it?[ J]. Cardiovasc Diabetol, 2020,
19(1): 102. DOI:10.1186/s12933-020-01085-6.
9. Rodbard D. Glucose variability: a review of clinical applications and
research developments[ J]. Diabetes Technol Ther, 2018, 20(S2):
S25-S215. DOI:10.1089/dia.2018.0092.
10. Danne T, Nimri R, Battelino T, et al. International consensus on use of
continuous glucose monitoring[ J]. Diabetes Care, 2017, 40(12): 1631-
1640. DOI:10.2337/dc17-1600.
11. Frontoni S, Di Bartolo P, Avogaro A, et al. Glucose variability: an
emerging target for the treatment of diabetes mellitus[ J]. Diabetes Res
Clin Pract, 2013, 102(2): 86-95. DOI:10.1016/j.diabres.2013.09.007.
12. Starup-Linde J, Lykkeboe S, Handberg A, et al. Glucose variability and
low bone turnover in people with type 2 diabetes[ J]. Bone, 2021, 153:
116159. DOI:10.1016/j.bone.2021.116159.
13. Yapanis M, James S, Craig ME, et al. Complications of diabetes and
metrics of glycemic management derived from continuous glucose
monitoring[ J]. J Clin Endocrinol Metab, 2022, 107(6): e2221-e2236. DOI:10.1210/clinem/dgac034.
14. Gerbaud E, Darier R , Montaudon M, et al. Glycemic variability
is a powerful independent predictive factor of midterm major
adverse cardiac events in patients with diabetes with acute coronary
syndrome[ J]. Diabetes Care, 2019, 42(4): 674-681. DOI:10.2337/
dc18-2047.
15. Zhang T, Su G, Mi SH, et al. Association between blood glucose
variability and the characteristics of vulnerable plaque in elderly nonST segment elevation acute coronary syndrome patients[ J]. Int Heart J,
2019, 60(3): 569-576. DOI:10.1536/ihj.18-503.
16. Gohbara M, Iwahashi N, Kataoka S, et al. Glycemic variability
determined by continuous glucose monitoring system predicts
left ventricular remodeling in patients with a first ST-segment
elevation myocardial infarction[ J]. Circ J, 2015, 79(5): 1092-1099.
DOI:10.1253/circj.CJ-14-1226.
17. Xia J, Xu J, Li B, et al. Association between glycemic variability and
major adverse cardiovascular and cerebrovascular events (MACCE)
in patients with acute coronary syndrome during 30-day follow-up[ J].
Clin Chim Acta, 2017, 466: 162-166. DOI:10.1016/j.cca.2017.01.022.
18. Zhang J, Yang J, Liu L, et al. Significant abnormal glycemic variability
increased the risk for arrhythmias in elderly type 2 diabetic patients[ J].
BMC Endocr Disord, 2021, 21(1): 83. DOI:10.1186/s12902-021-
00753-2.
19. Kim TJ, Lee JS, Park SH, et al. Short-term glycemic variability
and hemorrhagic transformation after successful endovascular
thrombectomy[ J]. Transl Stroke Res, 2021, 12(6): 968-975.
DOI:10.1007/s12975-021-00895-4.
20. Faselis C, Katsimardou A , Imprialos K , et al. Microvascular
complications of type 2 diabetes mellitus[ J]. Curr Vasc Pharmacol,
2020, 18(2): 117-124. DOI:10.2174/1570161117666190502103733.
21. He Z, King GL. Microvascular complications of diabetes[ J].
Endocrinol Metab Clin N Am, 2004, 33(1): 215-238. DOI:10.1016/
j.ecl.2003.12.003.
22. Lin CC, Chen CC, Chen FN, et al. Risks of diabetic nephropathy
with variation in hemoglobin A1c and fasting plasma glucose[ J].
Am J Med, 2013, 126(11): 1017.e1-1017.10. DOI:10.1016/
j.amjmed.2013.04.015.
23. Bragd J, Adamson U, Bäcklund LB, et al. Can glycaemic variability, as
calculated from blood glucose self-monitoring, predict the development
of complications in type 1 diabetes over a decade?[ J]. Diabetes Metab,
2008, 34(6 Pt 1): 612-616. DOI:10.1016/j.diabet.2008.04.005.
24. Kwai NCG, Arnold R , Poynten AM, et al. Association between
glycemic variability and peripheral nerve dysfunction in type 1
diabetes[ J]. Muscle Nerve, 2016, 54(5): 967-969. DOI:10.1002/
mus.25274.
25. Jun JE, Lee SE, Lee YB, et al. Continuous glucose monitoring defined
glucose variability is associated with cardiovascular autonomic
neuropathy in type 1 diabetes[ J]. Diabetes Metab Res Rev, 2019,
35(2): e3092. DOI:10.1002/dmrr.3092.
26. Nyiraty S, Pesei F, Orosz A, et al. Cardiovascular autonomic neuropathy
and glucose variability in patients with type 1 diabetes: is there an
association?[ J]. Front Endocrinol, 2018, 9: 174. DOI:10.3389/
fendo.2018.00174.
27. Tan TE, Wong T Y. Diabetic retinopathy: looking for ward to
2030[ J]. Front Endocrinol, 2023, 13: 1077669. DOI:10.3389/
fendo.2022.1077669.
28. Teo ZL, Tham YC, Yu M, et al. Global prevalence of diabetic
retinopathy and projection of burden through 2045: systematic review
and meta-analysis[ J]. Ophthalmology, 2021, 128(11): 1580-1591.
DOI:10.1016/j.ophtha.2021.04.027.
29. Zhai L, Lu J, Cao X, et al. Association between the variability of
glycated hemoglobin and retinopathy in patients with type 2 diabetes
mellitus: a meta-analysis[ J]. Horm Metab Res, 2023, 55(2): 103-113.
DOI:10.1055/a-1931-4400.
30. Cardoso CL, Leite NC, Moram CM, et al. Long-term visit-tovisit glycemic variability as predictor of micro- and macrovascular
complications in patients with type 2 diabetes: The Rio de Janeiro Type
2 Diabetes Cohort Study[ J]. Cardiovasc Diabetol, 2018, 17(1): 33.
DOI:10.1186/s12933-018-0677-0.
31. Park JY, Hwang JH, Kang MJ, et al. Effects of glycemic variability
on the progression of diabetic retinopathy among patients with
type 2 diabetes[ J]. Retina, 2021, 41(7): 1487-1495. DOI:10.1097/
IAE.0000000000003049.
32. 裴薇, 丁娇. 老年早期2型糖尿病肾病患者血糖波动与氧化应
激、炎症及单核细胞自噬的相关性研究[ J]. 中国老年保健医
学, 2021, 19(4): 48-51. DOI: 10.3969/j.issn.1672-2671.2021.04.015.
Pei W, Ding J. Study on the correlation between blood glucose fluctuation and oxidative stress, inflammation and monocyte autophagy in elderly patients with early type 2 diabetic nephropathy[ J]. Chin J Geriatr Care, 2021, 19(4): 48-51. DOI: 10.3969/j.issn.1672- 2671.2021.04.015.
Pei W, Ding J. Study on the correlation between blood glucose fluctuation and oxidative stress, inflammation and monocyte autophagy in elderly patients with early type 2 diabetic nephropathy[ J]. Chin J Geriatr Care, 2021, 19(4): 48-51. DOI: 10.3969/j.issn.1672- 2671.2021.04.015.
33. 苏弘薇, 康省, 龙艳, 等. 糖尿病肾病与血糖波动和炎性因子的关
系探讨[ J]. 中华老年心脑血管病杂志, 2015, 17(3): 273-276. DOI:
10.3969/j.issn.1009-0126.2015.03.014.
Su HW, Kang S, Long Y, et al. Relation of diabetic nephropathy and blood glucose fluctuation with inflammatory factors[ J]. Chin J Geriatr Heart Brain Vessel Dis, 2015, 17(3): 273-276. DOI: 10.3969/ j.issn.1009-0126.2015.03.014.
Su HW, Kang S, Long Y, et al. Relation of diabetic nephropathy and blood glucose fluctuation with inflammatory factors[ J]. Chin J Geriatr Heart Brain Vessel Dis, 2015, 17(3): 273-276. DOI: 10.3969/ j.issn.1009-0126.2015.03.014.
34. Costantino S, Paneni F, Battista R, et al. Impact of glycemic variability
on chromatin remodeling, oxidative stress, and endothelial dysfunction in patients with type 2 diabetes and with target HbA1c levels[ J].
Diabetes, 2017, 66(9): 2472-2482. DOI:10.2337/db17-0294.
35. 王景尚, 黄烨, 陈可冀, 等. 2型糖尿病患者血糖波动状态与血管
内皮损伤、血小板活化及PKCβ1表达的相关性[ J]. 中国中西
医结合杂志, 2016, 36(10): 1184-1190. DOI: 10.7661/CJIM.2016.
10.1184.
Wang JS, Huang Y, Chen KJ, et al. Correlation research on blood glucose fluctuation in type 2 diabetes mellitus patients and vascular endothelial injury/platelet activation/PKCβ1 expression[ J]. Chin J Integr Tradit West Med, 2016, 36(10): 1184-1190. DOI: 10.7661/ CJIM.2016.10.1184.
Wang JS, Huang Y, Chen KJ, et al. Correlation research on blood glucose fluctuation in type 2 diabetes mellitus patients and vascular endothelial injury/platelet activation/PKCβ1 expression[ J]. Chin J Integr Tradit West Med, 2016, 36(10): 1184-1190. DOI: 10.7661/ CJIM.2016.10.1184.
36. Piconi L, Quagliaro L, Assaloni R, et al. Constant and intermittent high
glucose enhances endothelial cell apoptosis through mitochondrial
superoxide overproduction[ J]. Diabetes Metab Res Rev, 2006, 22(3):
198-203. DOI:10.1002/dmrr.613.
37. Quagliaro L, Piconi L, Assaloni R, et al. Intermittent high glucose
enhances apoptosis related to oxidative stress in human umbilical vein
endothelial cells: the role of protein kinase C and NAD(P)H-oxidase
activation[ J]. Diabetes, 2003, 52(11): 2795-2804. DOI:10.2337/
diabetes.52.11.2795.
38. Guo C, Deshpande M, Niu Y, et al. HIF-1α accumulation in response
to transient hypoglycemia may worsen diabetic eye disease[ J]. Cell
Rep, 2023, 42(1): 111976. DOI:10.1016/j.celrep.2022.111976.
39. Li HY, Yuan Y, Fu YH, et al. Hypoxia-inducible factor-1α: a promising
therapeutic target for vasculopathy in diabetic retinopathy[ J].
Pharmacol Res, 2020, 159: 104924. DOI:10.1016/j.phrs.2020.104924.
40. Picconi F, Parravano M, Sciarretta F, et al. Activation of retinal Müller
cells in response to glucose variability[ J]. Endocrine, 2019, 65(3): 542-
549. DOI:10.1007/s12020-019-02017-5.
41. Stem MS, Dunbar GE, Jackson GR, et al. Glucose variability and inner
retinal sensory neuropathy in persons with type 1 diabetes mellitus[ J].
Eye, 2016, 30(6): 825-832. DOI:10.1038/eye.2016.48.
42. Battelino T, Alexander CM, Amiel SA, et al. Continuous glucose
monitoring and metrics for clinical trials: an international consensus
statement[ J]. Lancet Diabetes Endocrinol, 2023, 11(1): 42-57.
DOI:10.1016/S2213-8587(22)00319-9.
43. Jancev M, Vissers TACM, Visseren FLJ, et al. Continuous glucose
monitoring in adults with type 2 diabetes: a systematic review and
meta-analysis[ J]. Diabetologia, 2024, 67(5): 798-810. DOI:10.1007/
s00125-024-06107-6.
44. Ferreira ROM, Trevisan T, Pasqualotto E, et al. Continuous glucose
monitoring systems in noninsulin-treated people with type 2 diabetes:
a systematic review and meta-analysis of randomized controlled
trials[ J]. Diabetes Technol Ther, 2024, 26(4): 252-262. DOI:10.1089/
dia.2023.0390.
45. Munshi MN. Continuous glucose monitoring use in older adults
for optimal diabetes management[ J]. Diabetes Technol Ther, 2023,
25(S3): S56-S64. DOI:10.1089/dia.2023.0111.
46. Gupta A, Mukherjee S, Kumar Bhadada S, et al. Impact of shortterm application of continuous glucose monitoring system(CGMS)
on long-term glycemic profile in adolescents and adults with type
1 diabetes mellitus: an open-label randomized control cross over
study[ J]. Diabetes Res Clin Pract, 2024, 210: 111610. DOI:10.1016/
j.diabres.2024.111610.
47. Leite SAO, Silva MP, Lavalle ACR, et al. Use of continuous glucose
monitoring in insulin-treated older adults with type 2 diabetes[ J].
Diabetol Metab Syndr, 2023, 15(1): 240. DOI:10.1186/s13098-023-
01225-4.
48. Wang H, Zhou Y, Wang Y, et al. Basal insulin reduces glucose
variability and hypoglycaemia compared to premixed insulin in type
2 diabetes patients: a study based on continuous glucose monitoring
systems[ J]. Front Endocrinol, 2022, 13: 791439. DOI:10.3389/
fendo.2022.791439.
49. Elhabashy SA, Sakr EM, Salah NY. The efficacy of insulin degludec and
insulin glargine over NPH insulin among toddlers and preschoolers
with type 1 diabetes using glycemic variability and time in range[ J].
Eur J Pediatr, 2023, 182(4): 1857-1868. DOI:10.1007/s00431-023-
04857-w.
50. Lee YH, Kim DM, Yu JM, et al. Anagliptin twice-daily regimen
improves glycaemic variability in subjects with type 2 diabetes: a
double-blind, randomized controlled trial[ J]. Diabetes Obes Metab,
2023, 25(5): 1174-1185. DOI:10.1111/dom.14959.
51. Takuma K, Fuchigami A, Shigiyama F, et al. Comparison of the effects
of sitagliptin and dapagliflozin on time in range in Japanese patients
with type 2 diabetes stratified by body mass index: a sub-analysis of the
DIVERSITY-CVR study[ J]. Diabetes Obes Metab, 2023, 25(8): 2131-
2141. DOI:10.1111/dom.15089.
52. Ribeiro AKPL, Carvalho JPR, Bento-Torres NVO. Physical exercise
as treatment for adults with type 2 diabetes: a rapid review[ J]. Front
Endocrinol, 2023, 14: 1233906. DOI:10.3389/fendo.2023.1233906.
53. Chang CR , Francois ME, Little JP. Restricting carbohydrates at
breakfast is sufficient to reduce 24-hour exposure to postprandial
hyperglycemia and improve glycemic variability[ J]. Am J Clin Nutr,
2019, 109(5): 1302-1309. DOI:10.1093/ajcn/nqy261.
54. Liu D, Zhang Y, Wu Q, et al. Exercise-induced improvement of glycemic
fluctuation and its relationship with fat and muscle distribution in type
2 diabetes[ J]. J Diabetes, 2024, 16(4): e13549. DOI:10.1111/1753-
0407.13549.