抗青光眼术后脉络膜上腔出血:一例病例报告并文献复习
关键词
摘要
脉络膜上腔出血 (suprachoroidal hemorrhage, SCH)是一种罕见但严重威胁视力的手术并发症。此病多发于青光眼、角膜移植、白内障等术中或术后,主要临床表现为突然发作的视力下降,伴头痛及眼胀痛、眼压升高、前房浅,脉络膜呈棕黑色隆起。SCH的诊断主要依靠临床症状、眼部特征以及影像学检查,其中B超检查是金标准。该病的治疗方式依据脉络膜出血的程度及累及范围决定。若出血量小可保守治疗,待积血自行吸收。若存在“对吻征”、脉络膜脱离累及黄斑、眼压难以控制等情况则需进一步手术治疗。手术方式分为单纯巩膜外脉络膜上腔放液术或联合玻璃体切割术,最佳手术时机在出血后7~15 d,但该病预后往往不理想。因SCH对视力造成不可逆损害,故临床上对此病的预防、早期诊断与规范治疗尤其重要。本文通过回顾一例抗青光眼术后SCH病例的完整诊疗过程,并结合国内外近年来相关文献,对SCH的发病机制、临床表现、辅助检查、治疗进展进行系统总结,以期提升对于抗青光眼术后SCH的认识,进而降低 SCH 导致的严重视力损害发生率。
全文
文章亮点
1 关键发现
• 报道一例少见的抗青光眼术后脉络膜上腔出血 (suprachoroidal hemorrhage, SCH) 病例,并结合相关文献复习,更加全面地了解SCH的临床特征、发病机制、诊断、治疗及预后。
2 已知与发现
• 此病多发于青光眼、角膜移植、白内障等术中或术后,主要临床表现为突然发作的视力下降,伴头痛及眼胀痛,眼压升高、前房浅,脉络膜呈棕黑色隆起。• SCH对视力造成不可逆的损害,故临床上对此病的预防、早期诊断与规范治疗尤其重要。
3 意义与改变
• 要高度重视对SCH的预防管理,针对具有危险因素的患者尤其注意术中术后的眼压稳定。早期识别SCH的发生并积极处理,精准把握手术时机及选择合适的手术方式,才能最大限度地挽救患者视力。
脉络膜上腔出血(suprachoroidal hemorrhage, SCH)作为一种罕见但严重影响视力的并发症,最早于1760年由Baron de Wetzl首次报道[1]。其通常由眼内手术(如白内障手术、青光眼滤过手术、玻璃体切割术、巩膜扣带术、角膜移植术等)引起,既可在术中急性发生,也可于术后延迟出现[2-3]。最重要的风险因素是术中或术后眼压过低或骤降导致脉络膜上腔积液,牵拉睫状动脉破裂最终引起脉络膜上腔积血[4]。深入剖析 SCH 的疾病特征,有助于眼科医师在手术环节识别高危患者、规避风险,为患者制定精准化治疗方案。本例患者在发现SCH后13 d接受手术干预,术后眼部解剖结构恢复,视力得以保持,眼压得到控制。本文基于此病例,并结合既往文献展开回顾,从发病机制、临床表现、辅助检查及治疗进展进行系统总结,旨在深化眼科同仁对抗青光眼术后SCH的认知,为临床诊疗提供参考。
1 病例资料
患者男性,67岁,以“右眼青光眼术后视物不见1周”为主诉于2025年3月14日来我院就诊。9 d前患者因“右眼原发性开角型青光眼”于外院行Ex-PRESS引流钉植入术,术后右眼眼压波动在2~52 mmHg(1 mmHg=0.133 kPa)。1周前出现右眼视物不见,伴眼痛及同侧头痛,予对症支持治疗后症状无缓解,遂转至我院。患者既往有多年“双眼高度近视”病史,20年前曾行“右眼白内障+人工晶状体植入术”,7年前左眼因外伤于外院行“左眼眼球摘除联合义眼座植入术”。全身病史包括20年高血压,自诉目前药物控制可,否认血液系统疾病及抗凝药物服用史。入院查体:右眼裸眼视力为手动/眼前,矫正无提高,眼压为23 mmHg(局部应用酒石酸溴莫尼定滴眼液每天2次、马来酸噻吗洛尔滴眼液每天2次、布林佐胺滴眼液每天2次)。右眼滤过泡扁平,前房深浅正常,11点位引流钉在位,人工晶状体往鼻侧移位,眼底见玻璃体少许积血,脉络膜棕黑色球形实性隆起,透过间隙隐约见部分后极部视网膜平伏(图1A、B)。左眼义眼片在位。右眼B超提示条带状弧形隆起后中高回声信号,可见明显“对吻征”(图1C、D)。入院后给予患者局部抗炎、预防感染、降眼压、改善微循环、营养神经等药物治疗,2025年3月19日复查B超提示凝血液化,遂于次日行右眼玻璃体切割+巩膜外脉络膜上腔放液+硅油填充术(图2),术后患者第1天右眼视力为0.15,眼压为16 mmHg,眼底见脉络膜隆起较前明显减轻。OCT提示视网膜平伏,且在3周复查保持稳定(图3)。
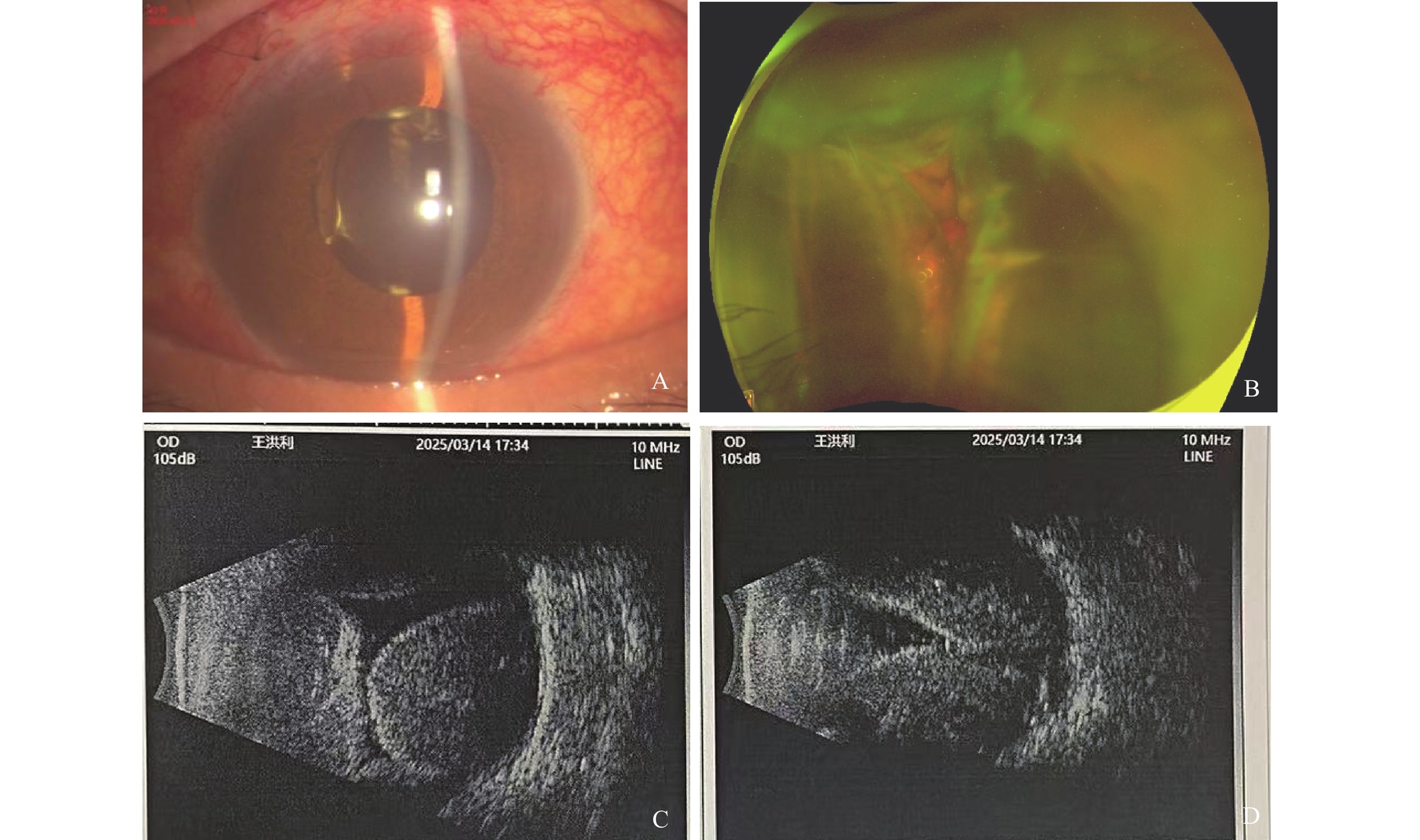
患者右眼结膜混合充血,滤过泡扁平,角膜透明,前房深浅正常,11点位引流钉在位,人工晶状体稍向鼻侧移位(A),眼底见多个半球形实性棕黑色隆起(B),眼部B超提示花环征(C)、“对吻征”及“三角征”(D)。
The patient presented with conjunctival mixed hyperemia, a flat filtering bleb, and a clear cornea. The anterior chamber depth was normal, with the 11-o'clock drainage implant in place and slight nasal displacement of the intraocular lens (IOL) (A). Fundus examination revealed multiple hemispherical, solid brown-black elevations (B). Ocular B-scan ultrasonography showed a "garland sign" (C), "kissing sign," and "triangle sign" (D).
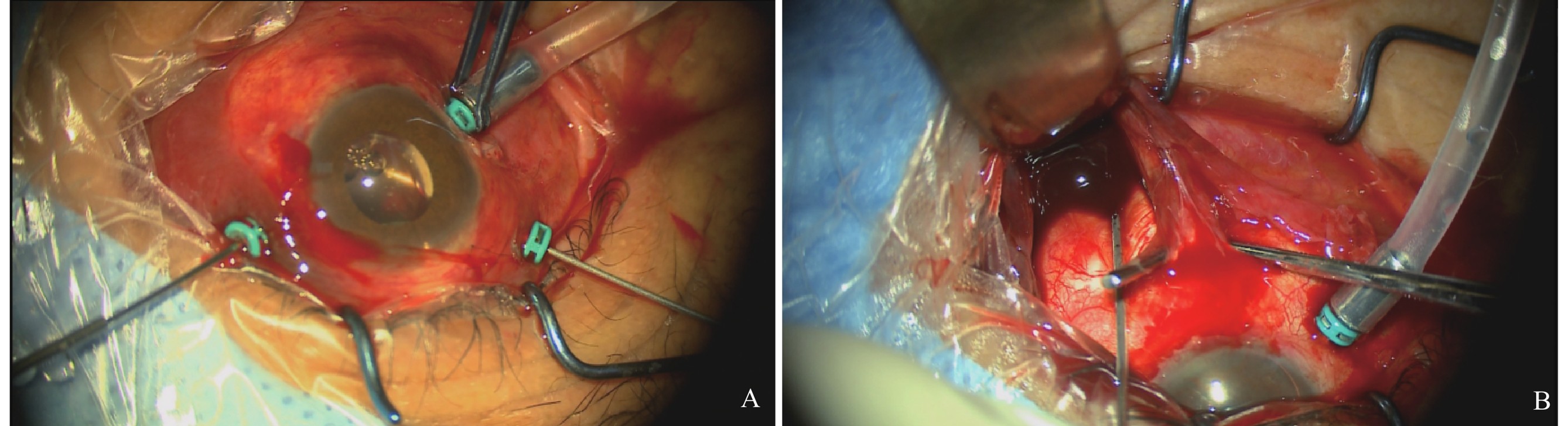
确认穿刺套管位于眼内,行25G玻璃体切割(A),于脉络膜隆起最高点行巩膜外放液,沿前缘轻微压迫巩膜,尽可能排出脉络膜上腔出血(B)。
After confirming the intraocular position of the trocar cannulas, 25-gauge pars plana vitrectomy was performed (A). External scleral drainage was conducted at the highest point of the choroidal elevation, with gentle compression applied to the sclera along the anterior edge to evacuate suprachoroidal hemorrhage as much as possible (B).
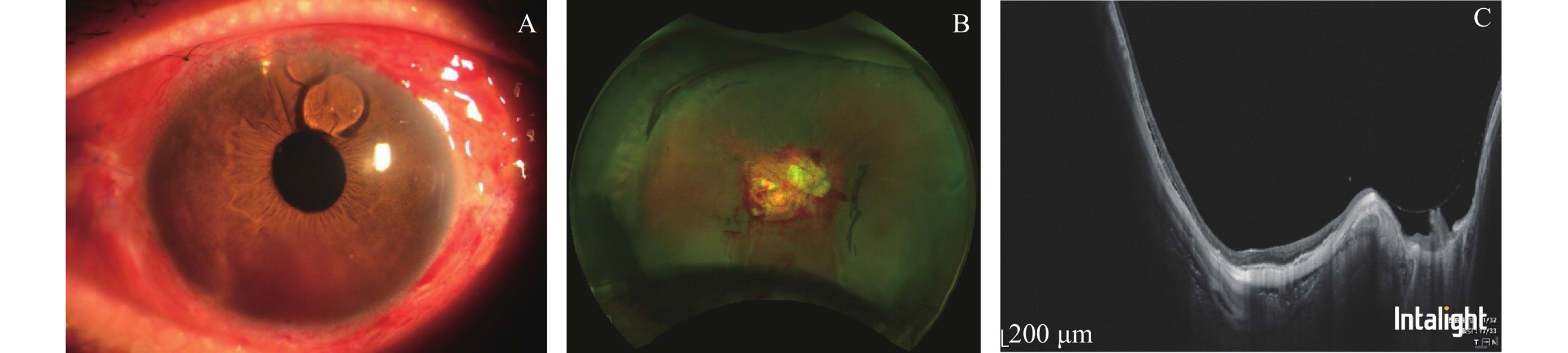
下方角膜后方有少许血性KP,前房见两个小硅油泡(A),眼底照相示玻璃体积血已清除,脉络膜棕黑色隆起较前明显减轻 (B),OCT提示黄斑区视网膜平伏,未见明显脉络膜隆起 (C)。
A small amount of hemorrhagic keratic precipitates (KP) were observed behind the inferior cornea, with two small silicone oil bubbles noted in the anterior chamber (A). Fundus photography revealed complete clearance of vitreous hemorrhage, and the brown-black choroidal elevation was significantly reduced compared with the preoperative state (B). OCT indicated that the macular retina was flat, with no obvious choroidal elevation detected (C).
2 讨论
SCH是指血液在脉络膜上腔的大量积聚,是一种罕见但严重损害视力的并发症[1, 5]。根据发生时间及严重程度,SCH可分为3类[6-8]:1)暴发性脉络膜上腔出血(expulsive SCH),多发生于内眼手术中,表现为眼压骤升、晶体虹膜隔前移、玻璃体脱出,病情进展迅猛,常伴剧烈眼痛与视力骤降;2)迟发性脉络膜上腔出血(delayed SCH),术后数小时至数天发生,症状渐进性加重,可见前房变浅、脉络膜隆起,眼压多正常或轻度升高;3)自发性脉络膜上腔出血 (spontaneous SCH),无明确外伤或手术史,多见于高血压、血液病或眼部炎症患者,临床表现差异较大,可伴随全身疾病症状。
SCH的发生、发展机制与脉络膜解剖结构密不可分。脉络膜内界为Bruch膜与视网膜RPE连接紧密,外界为大血管层与巩膜棕黑板层粘连疏松[9]。脉络膜上腔(suprachoroidal space, SCS)是巩膜和脉络膜之间的潜在间隙,维持眼压方面有重要作用。SCS厚度约为 35μm,由几层紧密排列的扁平梭形黑素细胞和成纤维细胞样细胞组成,其间散布有髓轴突束,在调节过程中脉络膜能够相对巩膜滑动[10]。脉络膜的血液供应主要来自睫状后短动脉及部分睫状后长动脉,低眼压可引起脉络膜上腔积液牵拉睫状后长或短动脉引起其破裂从而导致SCH的发生[1, 9, 11]。
SCH有多种危险因素,包括自身因素和外部因素,这些因素可导致脉络膜或睫状后动脉脆性或机械力增加[8, 12-16]。最常见的自身危险因素包括高龄、高血压、糖尿病、动脉硬化、凝血功能障碍或服用抗凝药物等。此外,高度近视、既往有眼内手术史,都可造成眼部解剖因素改变,导致眼压缓冲装置改变。角膜、白内障、青光眼等手术的术中眼压波动、咳嗽、呕吐等Valsalva动作导致静脉压升高,均可导致血管破裂。本例患者高龄,双眼高度近视及白内障病史,合并高血压,右眼引流钉植入术后的眼压波动进一步增加了SCH的风险。
低眼压是青光眼术后常见的并发症,可引起脉络膜脱离、低眼压黄斑病变、SCH等,且不同术式的 SCH 发生率存在差异[17]。一项针对青少年青光眼患者的研究显示,Ahmed 引流阀植入术后 SCH 发生率约 4.7%[18]。另外一项大型研究对比了小梁切除术与引流管植入术后SCH发生率,发现引流管植入术后SCH发生风险约为小梁切除术的2倍[19]。这一差异可能与研究中选择引流管手术的病例多为晚期青光眼有关,其术前眼压更高,术后更易出现低眼压状态,从而增加了 SCH 发生风险。另外一项荟萃分析比较了引流钉与小梁切除术的术后安全性及有效性,发现引流钉植入术后并发症更少[20]。而相对于小梁切除术、Ex-Press引流器植入术及引流阀植入术(如Ahmed、Baerveldt)等传统青光眼手术,新兴的微创青光眼手术如iStent植入术、Hydrus微型支架植入术、小梁网切开、XEN凝胶支架植入术等具有更高的安全性[21]。与传统小梁切除术相比,内路结膜下植入物滤过性微创青光眼术后眼压<6 mmHg时,不易引起低眼压相关并发症[22]。本例患者为独眼,单眼盲的患者对侧眼发生术中并发症的可能性很高[23]。因此,对于独眼且具有危险因素的患者青光眼手术的选择应尤其慎重。
SCH的诊断需结合临床表现与影像学特征进行综合判断。患者常以剧烈眼胀痛、头痛、突发视力丧失为主要症状,伴随眼压升高、前房变浅及可能出现前房积血;眼底检查可见单个或多个棕黑色球样隆起。若合并眼压升高、前房变浅时需与术后睫状环阻滞性青光眼鉴别。后者多发生于原发性闭角型青光眼,B 超无脉络膜脱离表现,而 SCH的B超特征具有诊断特异性:弧形高信号回声带下方伴中高回声出血征象,当脉络膜高度隆起相互接触时形成 “对吻征”,为脉络膜脱离严重需手术干预的标志性征象[24-27] 。此外,Bhatt 等[28]在36例SCH的患者中均发现在2个隆起的高回声信号与球壁之间存在1个呈低回声或无回声的三角形区域,称为“三角征”,也能为诊断提供参考。
SCH可对视力造成不可逆性损害,因此预防尤其重要[29]。首先,术前需完善眼部及全身系统检查,严格控制血压、血糖、眼压在安全范围,尽量避免阿司匹林等抗凝药物使用。在手术过程中,应保持血压和心率的平稳,术中通过黏弹剂、眼内灌注等方法减少眼压的波动。在青光眼滤过手术中,建议紧密缝合巩膜瓣,以避免术后低眼压,术后再根据患者眼压情况,逐步拆除巩膜瓣缝线。所有手术都建议严格闭合伤口。术后避免Valsalva动作减少静脉压波动,并积极控制炎症阻止脉络膜积液形成,从而阻断其向 SCH 进展的病理过程[1, 15]。
术中若怀疑急性SCH,应立即采取紧急处理措施,迅速缝合切口以防止眼内容物脱出,同时通过放松开睑器、采取头高脚低位减少眼部血流量,联合全身应用高渗剂(如20%甘露醇)快速降低眼压。如血压升高明显,可考虑舌下含服降血压药物(如硝酸甘油)。对于出血量较小的病例,可予以抗炎、预防感染、降眼压等药物保守治疗,多数可自行吸收消退[30]。若存在“对吻征”、脉络膜脱离累及黄斑、药物无法有效控制眼压等情况则可考虑手术治疗[31-32]。手术的主要目的是在维持眼压的同时引流SCH。
目前大多数专家认为最佳的手术时机在出血发生约7~15 d,待血凝块液化后行脉络膜上腔引流手术,此时有利于SCH的引流[33]。B超可以帮助监测血凝块溶解情况并识别SCH的最高点选择穿刺部位。然而,在某些情况下,例如“对吻征”、视网膜脱离,等待时间越长导致视力预后结局越差,立即引流可以带来更好的预后[2, 34]。此外,由于含铁血黄素会对视网膜脉络膜造成持续性损害,因此有学者建议早期清除SCH。尽管积血已凝固,可以通过脉络膜上腔应用组织型纤溶酶原激活剂(tissue plasminogen activator, t-PA)来溶解血凝块,但关于最佳剂量、部位和时机,仍需进一步研究[35]。
SCH 的手术方式需根据脉络膜出血的程度及累及范围决定。对于单纯脉络膜脱离且无玻璃体及视网膜受累者,手术可单纯巩膜外切开引流[32]。切开位置可选择睫状体平坦部、前部巩膜或者后部巩膜,需注意避免损伤涡静脉及眼外肌[15]。Pericak等[36]提出一种经穿刺口的脉络膜上腔出血引流术,使用23G巩膜穿刺刀以与结膜和巩膜近乎平行或呈约 15°~ 20°的入射角插入,从穿刺口引流积血,可以避免术后渗漏和低眼压、眼内炎、视网膜嵌顿的发生。术前可使用B超进行精准定位,必要时联合术中B超确保积血的清除[37]。若存在玻璃体积血或视网膜脱离,则可联合玻璃体切除手术,术中可借助重水维持眼内正压并引流积血[38-39]。眼内填充物包括硅油、气体及平衡盐溶液,硅油因能稳定眼压、减少再出血及预防视网膜脱离而成为首选[31, 40-41]。然而,也有研究证实惰性气体同样可以取得良好的解剖复位效果,且能减少手术次数[42]。
本例患者于出血后13 d(B 超证实积血液化)接受手术,鉴于其合并玻璃体积血及“对吻征”,采用巩膜外脉络膜上腔放液联合25G玻璃体切除+硅油填充术。术前通过 B 超定位脉络膜脱离最高点,于脉络膜隆起最高点行巩膜外放液,沿前缘轻微压迫巩膜,尽量排除脉络膜上腔出血及减少眼压波动。放液后行25G巩膜穿刺,确认穿刺套管位于玻璃体腔后清除玻璃体积血后再次引流,广角镜下确认脉络膜隆起减轻。由于患者为独眼,为帮助患者术后视力快速恢复、预防脉络膜上腔再次出血、抑制增殖性玻璃体视网膜病变以及降低术后低眼压的发生率[29],为视力恢复提供更稳定的眼内环境,笔者选择给患者眼内填充了硅油。此手术术中未使用重水,笔者的经验表明,眼内灌注联合巩膜外施压同样可以有效排出脉络膜上腔积血,避免了重水对视网膜的潜在毒性。
SCH的预后取决于多种因素,包括SCH的出现时间、部位、严重程度和范围。尽管多数患者经治疗后解剖结构可获改善,但最终视力预后仍不理想,大多数病例导致严重视力障碍或失明[6]。研究证实,合并年龄相关性黄斑变性、视网膜脱离、视网膜下出血及“对吻征”等因素者,视力预后更差[43]。全身应用糖皮质激素可能通过减轻脉络膜炎症反应,带来更显著的视觉改善[44]。
本例患者在经过治疗后,视力由手动/眼前提升至0.15。术后3周随访期间,眼压持续稳定在16 mmHg左右(未使用降眼压药物)。患者术前人工晶状体稍向鼻侧移位,提示悬韧带功能障碍,因此患者术后早期即发生了硅油移位。但前房硅油暂未发生严重并发症,后续可视SCH吸收情况及是否有角膜、前房的损害,酌情提前取出眼内硅油。
综上所述,SCH是青光眼术后一种严重的手术并发症。应高度重视对SCH的预防管理,针对高危人群需重点关注术中术后的眼压稳定。早期评估识别SCH并积极处理,精准把握手术时机及选择合适的手术方式,才能最大限度地挽救患者视功能。
声明
在论文撰写中无使用生成式人工智能。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。
基金
参考文献
1. Chu TG, Green RL. Suprachoroidal hemorrhage[J]. Surv Ophthalmol, 1999, 43(6): 471-486. DOI: 10.1016/S0039-6257(99)00037-5.
2. Oliver-Gutierrez D, Martin Nalda S, Segura-Duch G, et al. Delayed suprachoroidal hemorrhage after descemet stripping automated endothelial keratoplasty (DSAEK)[J]. Arch Soc Esp Oftalmol, 2023, 98(6): 355-359. DOI: 10.1016/j.oftale.2023.04.001.
3. Liu R, Tan B, Wang H, et al. Suprachoroidal hemorrhage associated with cataract surgery: a case series analysis[J]. J Int Med Res, 2025, 53(4): 03000605251332434. DOI: 10.1177/03000605251332434.
4. Jiang H, Gao Y, Fu W, et al. Risk factors and treatments of suprachoroidal hemorrhage[J]. Biomed Res Int, 2022, 2022: 6539917. DOI: 10.1155/2022/6539917.
5. Lata S, Bafna RK, Asif MI, et al. Suprachoroidal hemorrhage: a devastating complication of the eye[J]. BMJ Case Rep, 2020, 13(12): e238850. DOI: 10.1136/bcr-2020-238850.
6. Liu T, Elnahry AG, Tauqeer Z, et al. Visual and anatomic outcomes of suprachoroidal hemorrhage: a systematic review and meta-analysis[J]. Ophthalmol Retina, 2023, 7(6): 468-479. DOI: 10.1016/j.oret.2023.02.011.
7. Gressel MG, Parrish RK 2nd, Heuer DK. Delayed nonexpulsive suprachoroidal hemorrhage[J]. Arch Ophthalmol, 1984, 102(12): 1757-1760. DOI: 10.1001/archopht.1984.01040031421015.
8. Iheonunekwu C, Krasnoschlik NJ, Schramm J, et al. Spontaneous expulsive suprachoroidal hemorrhage[J]. Am J Emerg Med, 2023, 70: 210. e1-210. e3. DOI: 10.1016/j.ajem.2023.06.008.
9. Chiang B, Jung JH, Prausnitz MR. The suprachoroidal space as a route of administration to the posterior segment of the eye[J]. Adv Drug Deliv Rev, 2018, 126: 58-66. DOI: 10.1016/j.addr.2018.03.001.
10. Bowen RC, Raval V, Soto H, et al. Choroidal macrovessel: Systematic review and analysis of anatomic origin[J]. Surv Ophthalmol, 2022, 67(2): 570-578. DOI: 10.1016/j.survophthal.2021.07.003.
11. Dockery PW, Joubert K, Parker JS, et al. Suprachoroidal hemorrhage during descemet membrane endothelial keratoplasty[J]. Cornea, 2020, 39(3): 376-378. DOI: 10.1097/ICO.0000000000002199.
12. Flores Márquez A, Urbinati F, Rocha-de-Lossada C, et al. Management of suprachoroidal hemorrhage during phacoemulsification: a comprehensive review[J]. Medicina, 2023, 59(3): 583. DOI: 10.3390/medicina59030583.
13. Stringa F, Ali Z, Christou S, et al. Managing delayed suprachoroidal hemorrhage after insertion of XEN45 glaucoma device[J]. J Glaucoma, 2019, 28(5): e72-e74. DOI: 10.1097/IJG.0000000000001170.
14. Mohan S, Sadeghi E, Mohan M, et al. Suprachoroidal hemorrhage[J]. Ophthalmologica, 2023, 246(5-6): 255-277. DOI: 10.1159/000533937.
15. Mo B, Li SF, Liu Y, et al. Suprachoroidal hemorrhage associated with pars Plana vitrectomy[J]. BMC Ophthalmol, 2021, 21(1): 295. DOI: 10.1186/s12886-021-02062-7.
16. Stringa F, Kastner A, Heuer D, et al. Postoperative complications in glaucoma surgery: literature review-based recommendations to improve reporting consistency[J]. Br J Ophthalmol, 2022, 106(12): 1696-1702. DOI: 10.1136/bjophthalmol-2021-318952.
17. Balekudaru S, Basu T, Sen P, et al. Risk factors and outcomes of management of delayed suprachoroidal haemorrhage following Ahmed glaucoma valve implantation in children[J]. Br J Ophthalmol, 2020, 104(1): 115-120. DOI: 10.1136/bjophthalmol-2018-313804.
18. Vaziri K, Schwartz SG, Kishor KS, et al. Incidence of postoperative suprachoroidal hemorrhage after glaucoma filtration surgeries in the United States[J]. Clin Ophthalmol, 2015, 9: 579-584. DOI: 10.2147/OPTH.S78359.
19. Sun Y, Zhang B, Zhou R, et al. Trabeculectomy and EX-PRESS implantation in open-angle glaucoma: an updated meta-analysis of randomized controlled trials[J]. J Ophthalmol, 2019, 2019: 2071506. DOI: 10.1155/2019/2071506.
20. Ceran TH, Citirik M, Teke MY. Risk of complications in patients with one eye during and after ocular surgery[J]. Rom J Ophthalmol, 2024, 68(4): 409-414. DOI: 10.22336/rjo.2024.74.
21. El Hamichi S, Graversen VK, Gold AS, et al. Case report: suprachoroidal hemorrhage after chiropractic manipulation of the neck[J]. Optom Vis Sci, 2020, 97(7): 482-484. DOI: 10.1097/OPX.0000000000001533.
22. Safuri S, Bar-David L, Barak Y. Minimally invasive technique for choroidal fluid drainage[J]. Clin Ophthalmol, 2020, 14: 1955-1958. DOI: 10.2147/OPTH.S253989.
23. Oli A, Balakrishnan D. Multimodal imaging in a case of localized suprachoroidal hemorrhage[J]. J Ophthalmic Vis Res, 2020, 15(1): 104-108. DOI: 10.18502/jovr.v15i1.5956.
24. Bhatt VD, Bhatt DC, Bhatt KD, et al. The “triangle” sign: a novel ultrasound marker for diagnosing total choroidal detachment and total suprachoroidal hemorrhage[J]. Clin Ophthalmol, 2025, 19: 261-268. DOI: 10.2147/OPTH.S495062.
25. Chen X, Hou B, Yin L, et al. Treatment of massive suprachoroidal hemorrhage by drainage surgery with vitrectomy: experience of a single center[J]. Semin Ophthalmol, 2022, 37(6): 767-773. DOI: 10.1080/08820538.2022.2100711.
26. Lee SJ, Lee JH, Park SW, et al. Spontaneous resolution of massive expulsive suprachoroidal hemorrhage with good long-term visual outcome: a case report[J]. Int Med Case Rep J, 2015, 8: 185-187. DOI: 10.2147/IMCRJ.S92007.
27. Qureshi A, Jalil A, Sousa DC, et al. Outcomes of suprachoroidal haemorrhage drainage with and without vitrectomy: a 10-year study[J]. Eye, 2021, 35(7): 1879-1885. DOI: 10.1038/s41433-020-01170-w.
28. Pakravan M, Yazdani S, Afroozifar M, et al. An alternative approach for management of delayed suprachoroidal hemorrhage after glaucoma procedures[J]. J Glaucoma, 2014, 23(1): 37-40. DOI: 10.1097/IJG.0b013e31825afb25.
29. Akram H, Dowlut MS, Chandra A. Suprachoroidal haemorrhage (SCH) drainage using suprachoroidal tissue plasminogen activator (t-PA) after complicated cataract extraction (two-staged procedure): early intervention could mean better vision[J]. BMJ Case Rep, 2021, 14(5): e241705. DOI: 10.1136/bcr-2021-241705.
30. Pericak O, Chin EK, Almeida DRP. Trocar-based surgical approach to suprachoroidal hemorrhage drainage[J]. J Vitreoretin Dis, 2022, 6(6): 501-503. DOI: 10.1177/24741264211057674.
31. Shiraki N, Wakabayashi T, Sato T, et al. Intraoperative B-scan ultrasonography and pars Plana vitrectomy for severe open globe injury with hemorrhagic retinal and choroidal detachment[J]. Graefes Arch Clin Exp Ophthalmol, 2017, 255(11): 2287-2291. DOI: 10.1007/s00417-017-3771-1.
32. Boral SK, Agarwal D. Modified posterior drainage of post-operative suprachoroidal hemorrhage[J]. Indian J Ophthalmol, 2021, 69(12): 3584-3590. DOI: 10.4103/ijo.IJO_3533_20.
33. Nadarajah S, Kon C, Rassam S. Early controlled drainage of massive suprachoroidal hemorrhage with the aid of an expanding gas bubble and risk factors[J]. Retina, 2012, 32(3): 543-548. DOI: 10.1097/IAE.0b013e31822058e9.
34. Doğramacı M, Dikkaya F, Şentürk F, et al. Experimental laboratory modeling of choroidal vasculature: a study of the dynamics of intraoperative choroidal hemorrhage during pars Plana vitrectomy[J]. Turk J Ophthalmol, 2021, 51(5): 294-300. DOI: 10.4274/tjo.galenos.2020.64927.
35. Ribeiro M, Monteiro DM, Moleiro AF, et al. Perioperative suprachoroidal hemorrhage and its surgical management: a systematic review[J]. Int J Retina Vitreous, 2024, 10(1): 55. DOI: 10.1186/s40942-024-00577-x.
36. Yin CJ, Lou HD, Sun H, et al. Spontaneous suprachoroidal hemorrhage treated by gas tamponade in a refractory glaucoma patient with rhegmatogenous retinal detachment: a case report[J]. Am J Transl Res, 2024, 16(9): 5150-5154. DOI: 10.62347/IPIF6177.
37. Fan J, Hudson JL, Pakravan P, et al. Outcomes in patients with suprachoroidal hemorrhage after anterior segment surgery[J]. Clin Ophthalmol, 2022, 16: 4199-4205. DOI: 10.2147/OPTH.S379557.
38. Liu T, Elnahry AG, Tauqeer Z, et al. Factors associated with outcomes of suprachoroidal hemorrhage: an Individual Participant Data Systematic Review[J]. Retina, 2024, 44(7): 1242-1250. DOI: 10.1097/IAE.0000000000004081.
39. 黄晴予, 武志峰. 脉络膜结构与功能的研究进展[J]. 临床眼科杂志, 2023, 31(1): 83-86. DOI: 10.3969/j.issn.1006-8422.2023.01.022.
Huang QY, Wu ZF. Recent advances in the structure and function of the choroid[J]. J Clin Ophthalmol, 2023, 31(1): 83-86. DOI: 10.3969/j.issn.1006-8422.2023.01.022.
40. 王琳艳, 叶娟. 微创青光眼手术研究进展[J]. 中华实验眼科杂志, 2024, 42(6): 576-583. DOI: 10.3760/cma.j.cn115989-20210622-00366.
Wang LY, Ye J. Research progress of minimally invasive glaucoma surgery[J]. Chin J Exp Ophthalmol, 2024, 42(6): 576-583. DOI: 10.3760/cma.j.cn115989-20210622-00366.
41. 中华医学会眼科学分会青光眼学组. 中国结膜下植入物滤过性微创青光眼手术围手术期管理专家共识(2023年)[J]. 中华眼科杂志, 2023, 59(9): 696-701. DOI: 10.3760/cma.j.cn112142-20221230-00665.
Glaucoma Group of Ophthalmology Branch of Chinese Medical Association. Expert consensus on perioperative management of subconjunctival implant filtration minimally invasive glaucoma surgery in China (2023)[J]. Chin J Ophthalmol, 2023, 59(9): 696-701. DOI: 10.3760/cma.j.cn112142-20221230-00665.
42. 常恒, 黄堂睿, 程艺, 等. 恶性青光眼的诊疗进展[J]. 临床眼科杂志, 2023, 31(4): 372-377. DOI: 10.3969/j.issn.1006-8422.2023.04.020.
Chang H, Huang TR, Cheng Y, et al. Research progress on malignant glaucoma[J]. J Clin Ophthalmol, 2023, 31(4): 372-377. DOI: 10.3969/j.issn.1006-8422.2023.04.020.
43. 聂玉红, 陈震. 外伤性脉络膜上腔出血的手术策略[J]. 中国眼耳鼻喉科杂志, 2025, 25(1): 11-13+18. DOI: 10.14166/j.issn.1671-2420.2025.01.003.
Nie YH, Chen Z. Surgical strategies for traumatic suprachoroidal hemorrhage[J]. Chin J Ophthalmol Otorhinolaryngol, 2025, 25(1): 11-13+18. DOI: 10.14166/j.issn.1671-2420.2025.01.003.
44. 黄易, 胡海坚, 张旭. 暴发性脉络膜上腔出血的研究进展[J]. 国际眼科纵览, 2022, 46(6): 522-527. DOI: 10.3760/cma.j.issn.1673-5803.2022.06.009.
Huang Y, Hu HJ, Zhang X. Research progress of fulminant suprachoroidal hemorrhage[J]. Int Rev Ophthalmol, 2022, 46(6): 522-527. DOI: 10.3760/cma.j.issn.1673-5803.2022.06.009.