湿性年龄相关性黄斑变性脉络膜血管指数的三维特征与临床意义
关键词
摘要
目的:旨在利用超广角扫频源光学相干断层扫描血管成像(swept-source optical coherence tomography angiography, SS-OCTA)技术,探讨湿性年龄相关性黄斑变性(wet age-related macular degeneration, wet AMD)患者三维脉络膜血管指数(three-dimensional choroidal vessel index, 3D-CVI)的分布特征及其临床意义,揭示脉络膜血管结构的空间异质性及其在AMD病理中的潜在作用。方法:采用回顾性横断面研究设计,纳入2024年在成都大学附属医院就诊的41例wet AMD患者(51只患眼及31只对侧健眼)和15例健康对照者(30眼)。通过SS-OCTA技术,基于深度学习算法自动分割脉络膜中大血管层,测量黄斑中心凹及早期糖尿病视网膜病变干预研究分区(early treatment diabetic retinopathy study, ETDRS)的3D-CVI(脉络膜血管腔体积与总体积比值)和中心凹下脉络膜厚度(subfoveal choroidal thickness, SFCT)。结果:患眼组各区域(黄斑中心凹、下、上、鼻、颞区)、对侧健眼组黄斑中心凹3D-CVI均低于对照组(均P<0.01);患眼组与对侧健眼组SFCT较对照组差异无统计学意义(均P>0.05)。结论:wet AMD患者患眼及对侧健眼3D-CVI均显著降低,提示脉络膜可能存在血管萎缩及基质纤维化等结构性损伤,并具有双侧亚临床病理特征。且3D-CVI较SFCT能更敏感地反映脉络膜血管变化,有潜力作为早期诊断及病情监测的新型影像学生物标志物。
全文
文章亮点
1. 关键发现
• 本研究通过超广角扫频源光学相干断层扫描血管成像 (swept-source optical coherence tomographyangiography, SS-OCTA)技术,发现湿性年龄相关性黄斑变性(wet age-related macular degeneration, wet AMD)患眼及对侧健眼的三维脉络膜血管指数(three-dimensional Choroidal vessel index, 3D-CVI) 均较健康对照组显著降低,而黄斑中心凹下脉络膜厚度(subfovealchoroidal thickness, SFCT)则无显著差异。这表明wet AMD患者存在双侧性的脉络膜血管腔体积减小及基质纤维化等结构性损伤,且3D-CVI在捕捉这种隐匿性血管病理改变方面比SFCT具有更高的敏感性。
2. 已知与发现
• 既往研究已证实脉络膜灌注障碍在AMD发病中的核心作用,并指出二维CVI较易受生理因素波动的影响,且二维平面测量难以全面反映脉络膜血管的空间异质性;本研究在此基础上,通过三维量化(3D-CVI)突破了平面测量的局限,不仅验证了患眼脉络膜血管容积的全局性丢失,更关键地发现了对侧健眼存在亚临床血管退化特征。这一发现填补了SFCT无法识别早期或亚临床病变的缺陷,有力印证了wet AMD可能具有“双侧协同病理”特征。
3. 意义与改变
• 本研究确立了3D-CVI作为一种独立、客观且高敏感度的新型影像学生物标志物的临床潜力,其在反映脉络膜血流灌注与结构损伤方面优于传统形态学指标(如SFCT)。这一指标的引入将改变仅依赖视网膜形态学诊断的现状,为wetAMD的早期诊断、病理机制探索提供了从三维血管容积维度出发的新视角。特别是对侧健眼3D-CVI的改变,提示临床应重视对患者双眼的长期监测与早期干预,有助于在亚临床阶段识别高危风险,从而优化疾病的全程管理策略。
年龄相关性黄斑变性(age-related macular degeneration, AMD)是以视网膜黄斑区退行性病变为特征的致盲性眼病,高发于50岁以上人群。伴随人口老龄化加剧,现已成为全球老年视力损害的首要原因。根据年龄相关性眼病研究(Age-Related Eye Disease Study, AREDS)分类标准,AMD分为无AMD期、早期、中期和进展期[1]。进展期AMD可进一步分为干性AMD (dry AMD)和湿性AMD (wet AMD)[2],二者均可导致永久性中心视力丧失。脉络膜作为视网膜营养支持的核心结构,其由外向内依次为:脉络膜上腔、毛细血管层、Haller层、Sattler层和Bruch膜[3]。尽管AMD的确切发病机制目前尚未阐明,但多项研究证实,它与视网膜色素上皮层(retinal pigment epithelium, RPE)和Bruch膜的退行性改变密切相关[4]。因此,分析脉络膜血管的结构变化对揭示AMD病理机制至关重要[5]。
近十年来,随着眼底影像学技术的革新,光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)等多模态影像为AMD的诊疗提供了全新的思路[6–7]。其中,增强深度成像OCT (enhanced depth imaging optical coherence tomography, EDI-OCT)技术实现了脉络膜高分辨率成像,并使脉络膜厚度(choroidal thickness, CT)得以量化。既往常通过测量黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness, SFCT)来评估脉络膜变化情况,但该指标易受到多种生理因素影响,且个体差异性较大[8]。因此,Sonoda等[9]首次提出了通过Niblack二值化算法对基于EDI-OCT获取的图像进行量化:将暗像素化区域定义为血管腔面积(luminal area, LA),浅像素化区域定义为间质区面积(stromal area, SA),两者之和为脉络膜总面积(total choroid area, TCA),并利用LA/ TCA的比值来评估脉络膜血管的灌注状态。Agrawal等[10]对该方法进一步优化,并将其比值命名为脉络膜血管指数(choroidal vascularity index, CVI)。与SFCT相比,CVI受生理因素影响较小,具有客观性和可重复性,能更好反映疾病的病理生理过程。
然而既往多基于二维平面测量CVI,即通过单次OCT扫描计算所得,但由于脉络膜大中血管层厚度存在空间异质性[11],二维CVI (two dimensional CVI, 2D-CVI)难以全面反映脉络膜的整体变化。超广角扫频源光学相干断层扫描血管成像(swept-source optical coherence tomography angiography, SS-OCTA)作为第三代频域OCT技术,凭借其更长的激光波长,更高输出功率,显著降低了RPE散射干扰,能够基于三维平面显示脉络膜层的整体结构 [12]。SS-OCTA内置的深度学习算法可对扫描区域的CVI进行自动测量和量化,生成三维脉络膜血管指数(three-dimensional CVI, 3D-CVI)——脉络膜血管腔体积与脉络膜总体积之比[13]。该比值可反映脉络膜容积改变,对于评估脉络膜血流变化更具优势[14]。
当前AMD的早期诊断主要依赖玻璃膜疣、RPE异常等眼底形态学改变,尚缺乏敏感的血管功能指标。本研究利用超广角SS-OCTA量化wet AMD患眼的3D-CVI,并对比其对侧眼与正常人群的差异,旨在探究wet AMD脉络膜血管结构空间异质性特征及其在病理机制中的潜在作用。
1 资料与方法
1.1 一般资料
本研究属于回顾性横断面研究。纳入2024年于成都大学附属医院住院部确诊的wet AMD患者41例(82眼)为病例组,其中男25例、女16例,年龄52~83岁,平均为(70±7)岁,根据临床特征进一步分为患眼组(51眼)和对侧健眼组(31眼);纳入同期在成都大学附属医院就诊性别、年龄相匹配的健康对照组15名(30眼),其中男7例、女8例、年龄52~80岁,平均为(68±8)岁。
1.2 纳入与排除标准
纳入标准:经裂隙灯前置镜、SS-OCTA检查后,符合2023年中国专家共识《中国年龄相关性黄斑变性临床诊疗指南》[1]诊断标准,确诊为wet AMD。排除标准:1)合并眼前节病变影响眼底检查,如角膜云翳、角膜溃疡、翼状胬肉等;2)存在影响OCT检查的屈光间质混浊,如严重白内障、硅油填充眼、玻璃体腔积血等;3)合并其他眼底病变,如糖尿病视网膜病变、视网膜血管阻塞、中心性浆液性脉络膜视网膜病变等;4)合并眼部活动性炎症,如葡萄膜炎、巩膜炎等;5)合并青光眼、视神经病变等其他眼病;6)曾行内眼手术、抗血管内皮生长因子(vascular endothelial growth factor, VEGF)治疗或全视网膜光凝术(panretinal photocoagulation, PRP)治疗。本研究遵循《赫尔辛基宣言》,所有受检者均获取知情同意,研究方案经医院伦理委员会批准(批件号:2025037)。
1.3 测量方法
所有受试者均行使用超广角SS-OCTA[视微影像(河南)科技有限公司型号VG200D]内置基于U-Net架构的深度度学习算法进行脉络膜内外边界自动分割(脉络膜中大血管层默认为Bruch膜下25 μm至脉络膜-巩膜界面),采用人工智能技术自动识别脉络膜中大血管管腔和基质(图1)。根据ETDRS分区将图像划分为以黄斑中心凹为中心,直径3 mm范围的两个同心环,黄斑旁中心凹象限被进一步分为下(I)、上(S)、鼻(N)、颞(T)区四部分(图2、3)。并自动获得以下测量值:3D-CVI(脉络膜大中血管层管腔体积与所选区域脉络膜体积的比值×100%)、SFCT。
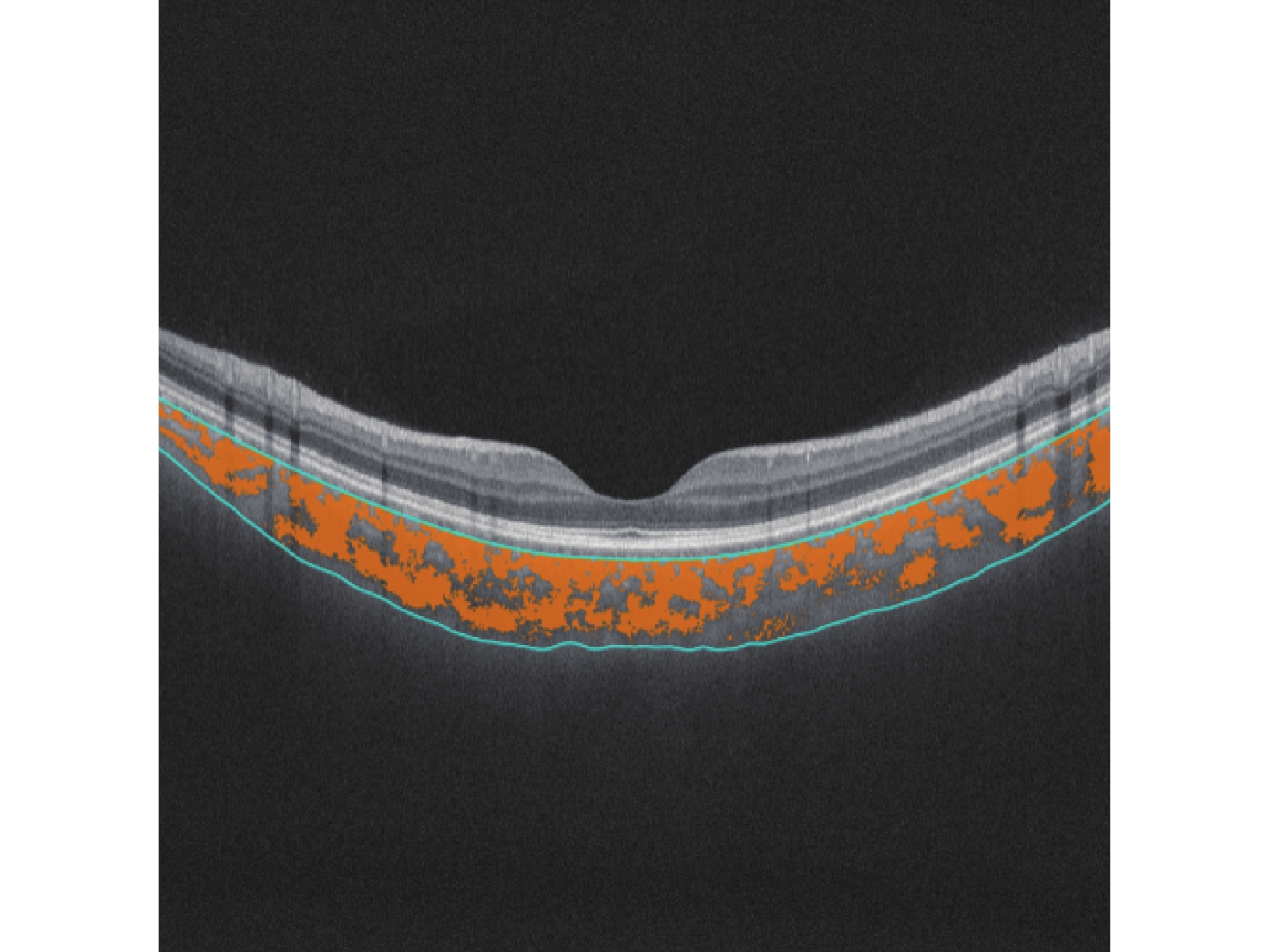
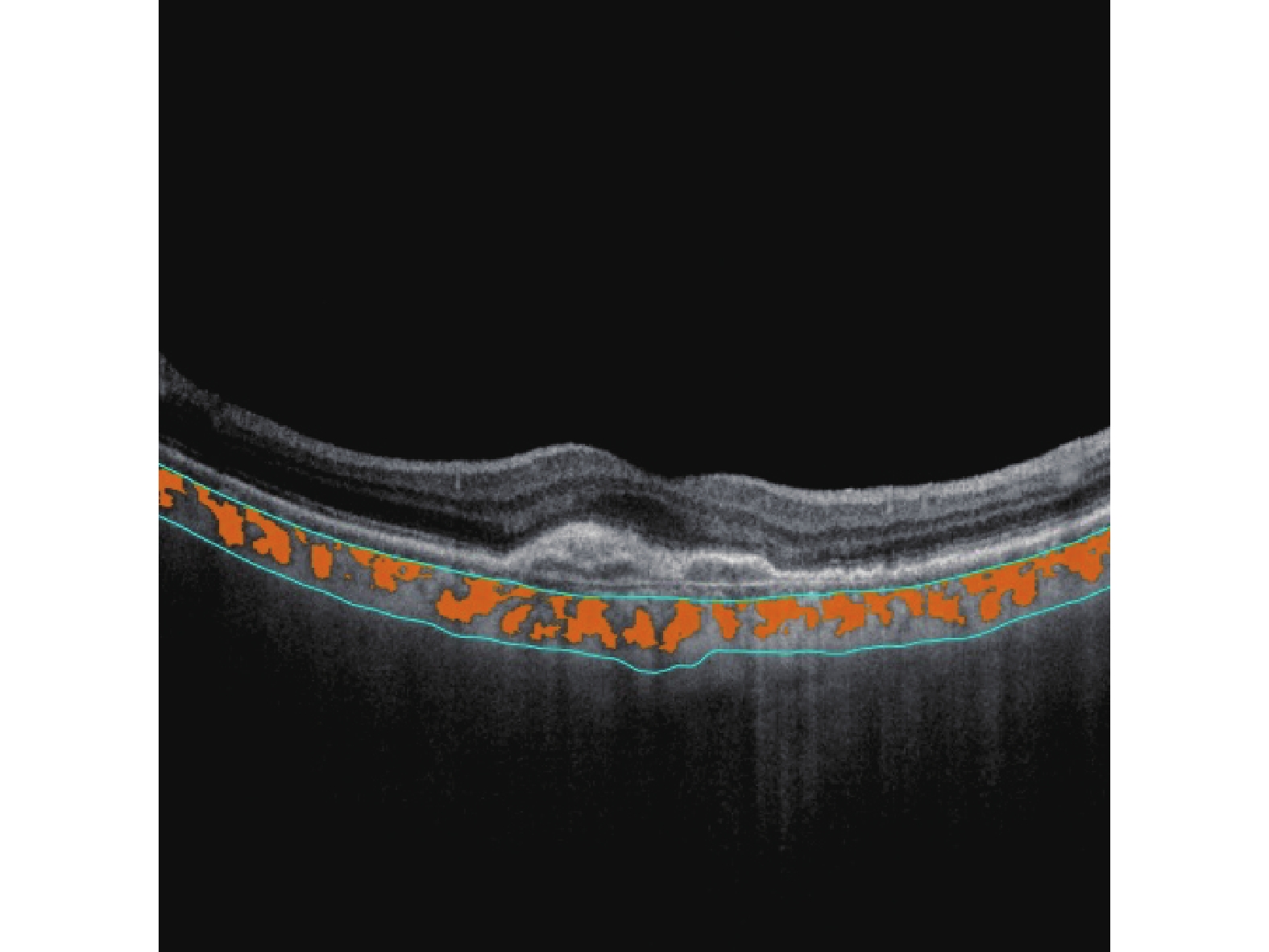
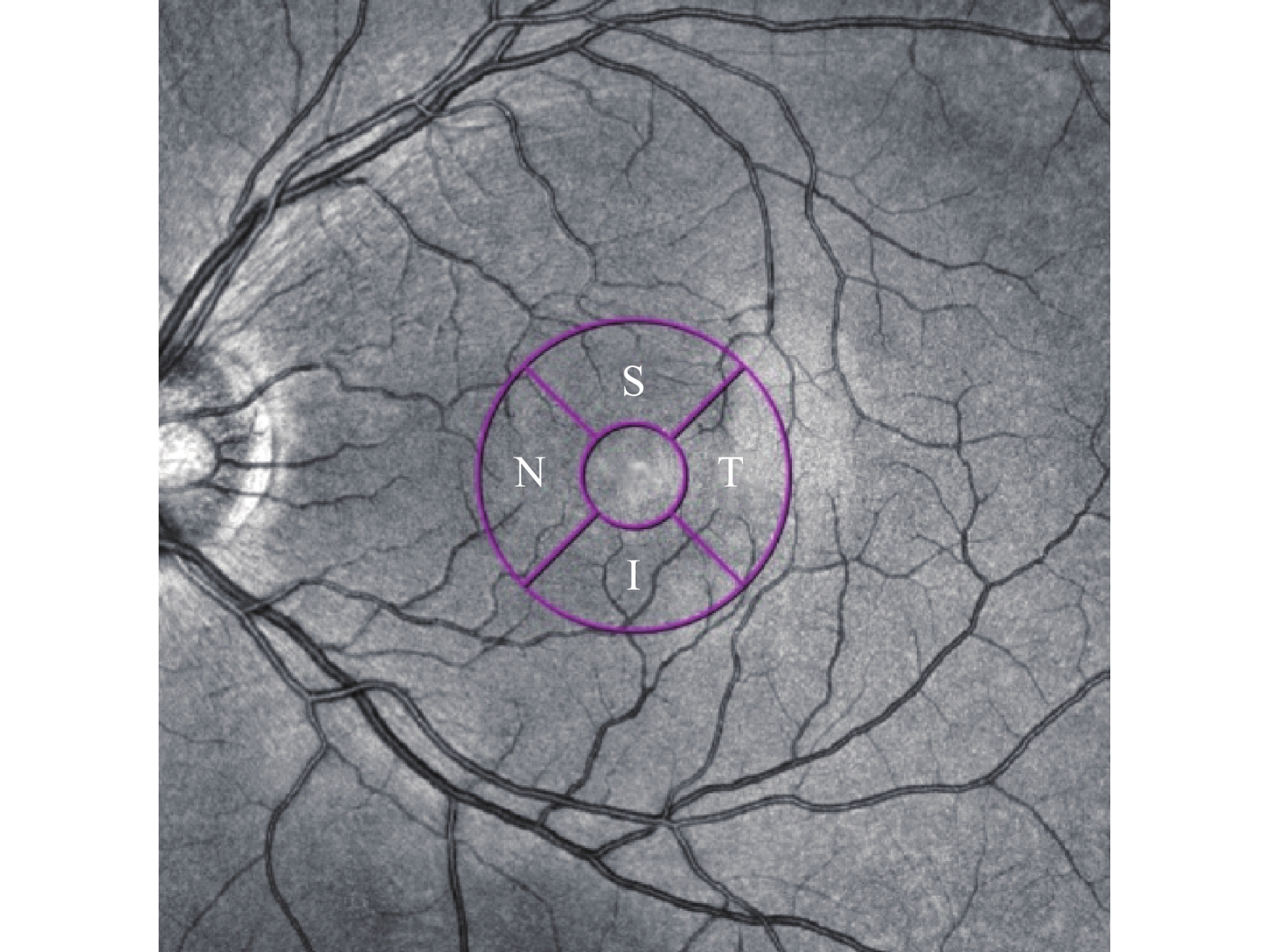
1.4 统计学分析
本研究数据通过SPSS 26.0统计软件处理完成,对计量资料进行正态性检验,所有结果均符合正态分布,以均数±标准差表示,组间比较采用独立样本t检验; 计数资料以[n(%)]表示,组间比较采用x2检验,多变量之间的相关性采用Spearman相关性分析,相关系数以rs表示。检验水准为α=0.05。
2 结果
2.1 对照组与病例组基本情况比较
两组患者年龄、性别、糖尿病、高血压等一般情况比较差异均无统计学意义(P>0.05),具有可比性。详见表1。
|
一般情况 |
|
对照组(n=15) |
病例组(n=41) |
t/χ2 |
P |
|
年龄/岁 |
|
68±8 |
70±7 |
−1.134 |
0.262 |
|
性别[n(%)] |
男 |
7(46.7) |
25(61.0) |
0.918 |
0.338 |
|
|
女 |
8(53.3) |
16(39.0) |
|
|
|
高血压[n(%)] |
|
9(60.0) |
27(65.9) |
0.164 |
0.686 |
|
糖尿病[n(%)] |
|
8(53.3) |
11(26.8) |
3.441 |
0.064 |
2.2 患眼组与对照组各区域3D-CVI比较
与对照组相比,患眼组各区域(黄斑中心凹、下、上、鼻、颞区)3D-CVI均降低,差异具有统计学意义(P<0.05),见表2。
|
分区 |
CVI/% |
t |
P |
Pa |
|
|
患眼组(n=51) |
对照组(n=30) |
||||
|
黄斑中心凹 |
0.344±0.117 |
0.464±0.043 |
6.563 |
<0.001 |
<0.01 |
|
下区(I) |
0.344±0.116 |
0.449±0.049 |
5.622 |
<0.001 |
<0.01 |
|
上区(S) |
0.358±0.122 |
0.445±0.055 |
4.353 |
<0.001 |
<0.01 |
|
鼻区(N) |
0.357±0.109 |
0.463±0.061 |
5.568 |
<0.001 |
<0.01 |
|
颞区(T) |
0.328±0.124 |
0.438±0.053 |
5.532 |
<0.001 |
<0.01 |
|
P:未校正的独立样本t检验结果;Pa:经Bonferroni法校正后结果,差异仍有统计学意义。 P-values: Results of the uncorrected independent samples t-test; P-valuea: Results after Bonferroni correction, with the differences remaining statistically significant. |
|||||
2.3 对侧健眼组与对照组黄斑中心凹3D-CVI比较
与对照组相比,对侧健眼组黄斑中心凹3D-CVI降低,差异具有统计学意义(P<0.01),见表3。
|
项目 |
对侧健眼组(n=31) |
对照组(n=30) |
t |
P |
|
CVI/% |
0.365±0.131 |
0.464±0.043 |
3.985 |
<0.01 |
2.4 患眼组、对侧健眼组与对照组SFCT(μm)比较
与对照组相比,患眼组、对侧健眼组SFCT均无明显变化,差异无统计学意义(P>0.05),见表4。
|
分组 |
SFCT/μm |
t |
P |
|
|
患眼组(n=51) |
对照组(n=30) |
|||
|
患眼组 |
238.255±94.978 |
260.833±67.928 |
1.140 |
0.258 |
|
对侧健眼组 |
238.903±92.441 |
|
1.058 |
0.295 |
2.5 黄斑中心凹3D-CVI的相关性分析
黄斑中心凹3D-CVI与高血压、糖尿病均无相关性(P>0.05)。见表5。
|
指标 |
高血压 |
糖尿病 |
||
|
rs |
P |
rs |
P |
|
|
CVI |
−0.021 |
0.826 |
−0.020 |
0.835 |
3 讨论
AMD的发病机制与脉络膜血管介导的RPE层和Bruch膜退行性改变密切相关,组织学研究表明,AMD患眼脉络膜间质的病理改变[15],证实了脉络膜灌注障碍在疾病进展中的关键作用。脉络膜作为一种血管密集组织,这种新型血管指数的表征有助于进一步阐明脉络膜内血管过程的作用,用于评估疾病的发生和进展。CVI作为一种非侵入性且易于获得的脉络膜定量参数,与传统测量指标相比,具有更高的敏感性与稳定性[16],能直接反映和量化脉络膜血管系统的结构变化。2016年,Agrawal等[17]在一项关于新加坡马来人的研究中,首次报道健康人群的平均CVI为65.6%±2.3%,这表明血管组织约占正常中心凹下脉络膜体积的三分之二。在一项基于健康个体的小样本观察研究中,该参数也表现出了良好的昼夜稳定性[18]。同时在计算各种眼部和全身视力相关疾病的CVI小组中也获得了可重复的结果[19]。多项研究证明了其作为评估眼部和全身疾病进展和预后的工具的有效性[17]。
本研究结果显示,wet AMD组患眼、对侧健眼组黄斑中心凹3D-CVI较正常对照组差异均有统计学意义,wet AMD组黄斑旁中心凹各象限3D-CVI也同步降低(P<0.01),这表明黄斑中心凹及旁中心凹各象限脉络膜血管结构均发生了明显改变。此结果与Lilian等[20]报道一致:wet AMD患者患眼的CVI多呈下降趋势,其正常对侧眼的CVI 也低于正常对照组。这提示即使临床上无明显表现的“正常对侧眼”也可能存在潜在的脉络膜血管改变。他们认为CVI的降低可能与脉络膜缺血相关,这可能是AMD病理机制中的重要环节。当脉络膜血管缺血可引起视网膜色素上皮细胞缺氧,进而导致VEGF表达上调,最终刺激新生血管的产生[21]。既往研究进一步证实,脉络膜血流量减少与AMD的双眼协同病理假说和脉络膜新生血管(choroidal neovascularization, CNV)形成发展的风险增加显著相关[22]。这些变化均提示CVI在AMD的发病机制中可能具有重要的病理生理意义。wet AMD患者的脉络膜毛细血管因长期缺血、氧化应激或炎症刺激导致内皮细胞凋亡,正常血管网络逐渐退化,血管面积减少。对于wet AMD患者而言,脉络膜血管减少的现象可能提示其脉络膜血管系统遭受了更为显著的病理损伤,而CVI的降低进一步说明这可能与脉络膜血管萎缩或基质纤维化等累积效应有关。
脉络膜厚度作为传统的形态学指标,目前大多数研究认为其随着年龄增长、近视程度加深而变薄,且具有位置依赖性特征(黄斑中心凹最厚,颞侧次之,鼻侧最薄)[23],同时还受到许多其他因素的影响。脉络膜作为血管高度化的组织,也是人体内血管化程度最高的组织之一[24],其厚度随血流灌注情况改变而变化[25],不仅能够直接反映脉络膜形态学的改变,也能间接反映其血流的灌注情况。有研究提出,在病理状态下,脉络膜血流减少会导致相对缺氧的环境,且随着疾病的进展CT值也会进一步发生改变[26]。尽管脉络膜循环障碍被认为参与AMD发病机制,但CT在AMD中的改变尚存争议。Wood等[27]研究报道,早期AMD组与对照组相比,各部位脉络膜厚度均无显著差异,这提示早期AMD患者脉络膜厚度可能并未受到影响。而Manjunath等[28]发现,AMD患者的脉络膜厚度存在显著差异,部分患者脉络膜变薄,且湿性患者较干性更显著,提示脉络膜变薄可能与wet AMD的进展有关。在本研究中,wet AMD患眼组与对侧健眼组SFCT较对照组均无统计学差异(P>0.05)。
全身基础疾病对CVI的影响同样需要关注。糖脂等代谢异常性疾病可通过微血管病变、氧化应激或炎症反应间接损伤脉络膜血管结构。研究表明,高血压患者的中小血管硬化及血管内径狭窄可导致CVI的降低[29];而糖尿病患者的慢性高血糖状态亦与脉络膜全层血管损伤相关,加速了血流灌注减少进程[30]。本研究中黄斑中心凹3D-CVI与高血压、糖尿病未体现出显著相关性(rs=−0.021,P=0.826;rs=−0.02,P=0.835),这可能是因为样本量相对有限导致,且3D-CVI聚焦于脉络膜大中血管层,而高血压、糖尿病可能更早累及脉络膜毛细血管层[31]。此外,wet AMD本身所致的显著脉络膜血管改变也可能掩盖了全身性疾病的叠加效应。尽管这一发现提示了3D-CVI作为相对独立生物学指标的潜力,但全身性疾病对脉络膜血管的潜在损伤不可忽视。
综上所述,本研究基于SS-OCTA对wet AMD患者的视网膜及脉络膜形态结构三维成像证实:wet AMD组脉络膜血管指数(3D-CVI)显著降低,这可能与脉络膜毛细血管层萎缩及基质纤维化等血管结构损伤相关。既往组织学证据表明wet AMD患眼的脉络膜毛细血管密度减少,内皮细胞凋亡增加,而SS-OCTA的高分辨率三维成像进一步揭示了血管体积的全局性损失。值得注意的是,对侧健眼3D-CVI同步下降提示了wet AMD可能具有双侧亚临床血管退化,印证了Lilian等[20]提出的“双眼协同病理假说”。此类患者需密切随访,警惕对侧眼发病风险。本研究中,SFCT未显示组间差异,这可能与该研究的不足之处有关:1)本研究为单中心回顾性横断面设计,研究样本量较小,需扩大样本量来验证结论的正确性与相关性。且未进行纵向随访,难以评估3D-CVI的动态变化与疾病进展的关联。2)未校正眼轴长度(axial length,AL)等屈光参数,既往研究证实高度近视患者因机械性拉伸作用可导致脉络膜血管重构。本研究虽排除了合并其他眼底病变者,但未量化AL值,无法排除屈光状态差异对结果的影响。3) SS-OCTA的成像深度和分辨率虽优于传统OCT,但对深层脉络膜血管的显示仍存在挑战。算法依赖自动分割技术,可能导致血管分割误差。且目前3D-CVI的测量缺乏国际统一标准,这限制了结果的横向可比性。除此之外,SFCT受脉络膜厚度测量位置和血流动力学的瞬时波动影响较大,3D-CVI通过量化血管-基质体积比消除了部分干扰因素,能更稳定地反映血管结构损伤的累积效应。既往研究亦证实[32],脉络膜血管指数变化独立于CNV亚型及治疗史。这表明脉络膜血管指数有潜力作为AMD诊断及病情评估的新型生物标志物,3D-CVI的出现更是通过多维度、高分辨率量化脉络膜血管结构,提升了临床诊断的准确性,有望成为AMD亚临床阶段筛查的新工具。尽管目前学界尚未完全阐明脉络膜血管变化与血流动力学之间的具体作用机制,但临床观察数据表明,监测脉络膜血管指数的变化对疾病进展具有预警价值,这为AMD的早期干预提供了新的评估维度。
声明
在论文撰写中无使用生成式人工智能。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。
基金
参考文献
Chinese Vitreo-Retina Society of Chinese Medical Association, Fundus Disease Group of Chinese Ophthalmologist Association, Xu Xun. Guidelines for clinical diagnosis and treatment of age-related macular degeneration in China (2023)[J]. Chin J Ophthalmol, 2023, 59(5): 347-366. DOI: 10.3760/cma.j.cn112142-20221222-00649.
Zhu YJ, Chen X, Wei W. Research progress on the relationship between choroidal thickness and age-related macular degeneration[J]. Int Eye Sci, 2022, 22(11): 1804-1808. DOI: 10.3980/j.issn.1672-5123.2022.11.08.
Zhang HR. The influencing factors of the choroidal thickness and choroidal vascularity index changes in hypertensive patients[D]. Shenyang: China Medical University, 2023. DOI: 10.27652/d.cnki.gzyku.2023.001146.
Wang XK. Changes of choroidal structure in diabetic patients[D]. Jinan: Shandong University, 2023. DOI: 10.27272/d.cnki.gshdu.2023.006847.