“精于诊断,准其治疗”——精准医疗背景下北京大学第三医院干眼特色诊疗平台建设的探索与分析
阅读量:15492
DOI:10.3978/j.issn.1000-4432.2021.03.05
发布日期:2023-05-12
作者:
董芮岚 ,周义霖 ,原昊 ,江晓丹 ,张可心 ,夏华钦 ,杨嘉瑞 ,李学民
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
干眼
精准医疗
北京大学第三医院
诊疗平台
摘要
在大力发展精准医疗的时代背景下,北京大学第三医院眼科中心率先建立干眼精准医疗平台。通过规范和优化干眼诊疗流程,为患者提供个性化的治疗方案和预防指导意见,有效提高了干眼诊断的精确性与治疗的有效性,同时提升了干眼门诊接诊效能,改善了患者就诊体验。本文将从干眼精准医疗平台体系的建设内容、标准化的检查流程、个性化的诊疗方案等方面进行阐述,并结合实际临床案例,综合分析北京大学第三医院在干眼精准医疗方面进行的探索,展望干眼精准医疗平台的前景与未来。
全文
随着电子科学技术的发展、工作方式的转变和气候环境的变化,干眼发病率逐年增长,干眼患者的就医需求逐渐增加。干眼相关检查方式种类繁多,目前我国各地区各级别医院对干眼的诊疗流程尚未统一,诊疗水平存在一定差距。无形中,可能造成医疗资源浪费和诊疗效率低下等问题。本文旨在介绍北京大学第三医院干眼精准医疗平台建设和临床实践情况,试图提出一套可行的干眼精准医疗流程,以期提高干眼诊疗效能,促进精准医疗在眼科疾病领域的应用和发展。
1 干眼与精准医疗
1.1 干眼
干眼是由多种因素引起的,以眼睛干涩为主要症状的泪液分泌障碍性疾病,其本质是泪液质和量异常或动力学异常导致的泪膜稳定性下降,常伴有双眼痒感、异物感、烧灼感、畏光、视物模糊、视力波动等症状。由于电子科技产品的普及和现代工作、生活方式的转变,干眼逐渐成为眼科门诊最常见的疾病。截至2018年,流行病学调查报告[1]显示:全球干眼发病率为5%~50%,我国干眼发病率约38.89%。
然而干眼的病因和严重程度均存在较大的异质性,具有个体差异较大、症状体征不相符等特点。根据病因不同,干眼可以分为水样液缺乏性干眼(aqueous tear deficiency dry eye,ADDE)、黏蛋白缺乏性干眼、蒸发过强性干眼和泪液动力学(分布)异常所致干眼。ADDE主要由先天(如先天性无泪腺症)或后天(如外伤、准分子激光原地角膜消除术(laser-assisted in situ keratomileusis,LSAIK)、某些自身免疫性疾病等)因素造成的泪腺功能低下所致,黏蛋白缺乏性干眼主要由沙眼、眼类天疱疮、化学伤等所致,蒸发过强性干眼主要由脂质层质或量的异常引起,如睑板腺功能障碍(meibomian gland dysfunction,MGD)所致干眼,泪液动力学(分布)异常所致干眼由眼睑缺损、内外翻导致瞬目不完全、泪液不能均匀分布引起[2]。不同患者所患干眼的严重程度可存在较大差异,轻度干眼可以仅有体征无症状,重度干眼可出现严重的磨痛感、畏光流泪、角膜上皮损伤、视力下降,甚至严重降低生活质量。因此,干眼的个性化诊疗显得尤为迫切和必要。
然而,传统诊疗模式存在一定的弊端和局限性。目前临床上针对干眼患者主要以传统的人工泪液、热敷、抗炎药、泪点栓塞等对症治疗为主,往往将所有患者一概而论,而忽略了其个体性,干眼患者无法得到个性化的病因诊断与精确治疗。例如由角膜神经损伤所致的干眼患者往往欠缺神经营养治疗,受损神经无法修复,干眼进展难以控制。特殊类型干眼如干燥综合征(Sj?gren syndrome,SS)、Stevens-Johnson综合征(Stevens-Johnson syndrome,SJS)和阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)患者,可能忽略全身疾病的治疗,以致延误病情,造成其他脏器损伤。
1.2 精准医疗的概念
随着人类基因组及蛋白质组计划的完成、各类分子生物技术、生物信息学及互联网大数据分析技术的发展,人们对传统医疗模式提出了更高要求。2011年,美国国家研究委员会[3]在《迈向精准医学:建立生物医学与疾病新分类学的知识网络》报告中,首次正式提出精准医疗的概念。
精准医疗是基于个体分子医学和精细医疗操作的新型医疗模式,通过对患者进行分子影像学、分子病理学及组学等检测,结合患者的生活环境和生活方式,对患者做出精确诊断并提出个性化治疗方案,旨在最大化利用公共医疗资源,实现患者个体的最佳治疗效果和最小不良反应[4]。
2015年,奥巴马在美国国情咨文中再次提及“精准医学计划”[5]。鉴于精准医疗所带来的巨大医疗模式转变和在提升医疗质量方面的广阔前景,为改善我国国民健康、促进我国医疗水平提升,经有关主管部门及专家共同研究决定,我国积极跟进时代发展趋势,对精准医疗予以高度重视,并将其纳入“十三五”重大科技计划。
1.3 北京大学第三医院干眼精准医疗平台的构建
眼是一个精密的感光器管,眼科学与光医学、生物材料医学、组织工程学等学科的交叉发展为精准医疗的实践提供了绝佳的落脚点[6]。2016年,北京大学第三医院响应号召,积极开展精准医疗实践与相关制度建设。我院眼科中心结合学科特点,团结科室力量,优先建立了干眼精准医疗平台。
干眼相关检查方式极其繁杂,涉及病理学、血清学、分子影像学等多领域的技术。对任何患者穷尽所有相关检查方式以确诊干眼并进行分型显然是不现实的,而固定简略的传统诊疗流程并不能完全覆盖所有患者的需求。我院眼科通过构建干眼精准医疗平台,期望规范并优化干眼诊疗流程,打造个性化检查和治疗方案,提高干眼诊断的精确性与治疗的有效性,同时提升干眼门诊接诊效能,实现由粗犷型向集约型的医疗模式转变。
2 北京大学第三医院干眼精准医疗平台体系
北京大学第三医院干眼精准医疗平台体系是一套完整的干眼诊疗规范化流程,主要包括对于主观症状、客观体征的评估以及眼表相关辅助检查、病理检查和分子检测五部分,可对不同患者进行精确诊断分型,并辅助制定个性化治疗方案(图1)。
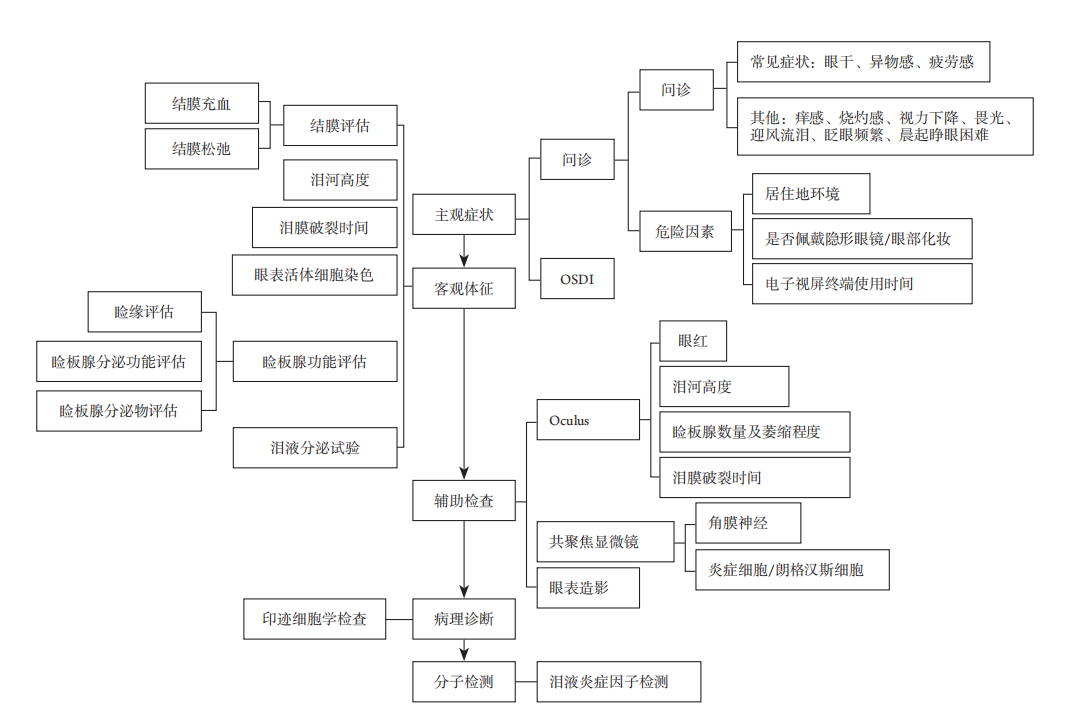

图1 北京大学第三医院精准医疗平台体系
Figure 1 Precision medical platform system of Peking University Third Hospital
2.1 主观症状
2.1.1 问诊
对于存在眼部干涩感、异物感、疲劳感等干眼常见症状的患者,进一步询问是否存在痒感、烧灼感、视力下降、畏光、迎风流泪、眨眼频繁或晨起睁眼困难等其他症状,及上述症状的出现时间、持续时间、发作频率和严重程度,了解发作的加重因素(如接触烟雾、光、风、空调或看电视、手机、电脑屏幕等)和缓解因素(如眨眼、使用人工泪液或加湿器等)。对于出现畏光及灼烧感的患者,需考虑为角膜神经损伤相关干眼;对于电子产品使用时间过长的患者,需考虑视觉显示终端综合征(visual display terminal,VDT)可能;对于严重眼干的患者,应询问是否伴有口干、关节痛,以排除SS。
常规询问患者的眼部疾病史、手术史及用药史,了解全身疾病及用药情况。存在药敏史者,考虑SJS可能。特别地,需关注患者的居住地环境(如城市/农村、高温/温度适宜/寒冷/潮湿/干燥/高海拔等),询问患者是否佩戴角膜接触镜或进行眼部化妆(如眼霜、眼线、睫毛膏等),了解上述行为的频率、持续时间及与症状的关系。
由于干眼是一种典型的症状与体征分离的疾病,临床上应对症状和体征给予同等程度的重视。详细的问诊不仅可以更全面地了解患者的症状,避免漏诊,还有助于推测患者发病的诱因,辅助干眼精准诊断和分型,为治疗和预防提供个体化的指导意见。
2.1.2 眼表疾病指数量表
由于干眼症状的多样性和主观性以及症状体征分离,有必要采用统一的国际标准对症状进行定量分析,同时辅助评估干眼的严重程度,以利于干眼的个性化诊断和治疗,同时有助于检测疾病进展和检验治疗效果。我院采用眼表疾病指数(Ocular Surface Disease Index,OSDI)量表,主要包括眼部不适感、视觉功能障碍及对环境因素的敏感性3个部分,评估的症状共计1 2项,根据过去的1周患者出现问卷中症状的频率进行评分,从而评估患者眼部刺激症状的严重程度及其对视觉相关功能的影响,辅助诊断干眼[7]。OSDI评分为0~12分属于正常范围,干眼可能性低;>12分考虑干眼可能。OSDI分数高低对于评估轻度(13~22分)、中度(23~32分)和重度(33~100分)干眼有提示意义,其中重度干眼往往提示S S、SJS可能性大。
2.2 客观体征
2.2.1 结膜评估
结膜评估包括结膜充血程度和结膜松弛程度两部分。结膜充血程度依据眼科研究所(Institute for Eye Research,IER)分级量表进行评估:0=无充血;1=充血局限在穹隆部,血管呈鲜红色;2=充血明显达睑裂部,血管呈深红色,模糊不清;3=整个结膜弥漫充血,血管呈紫红色,看不清正常睑板纹理[8]。结膜充血严重往往提示有眼表浅层炎症,在治疗上可加用激素或非甾体抗炎药。结膜松弛程度评估主要观察眼睑平行结膜皱褶(lid-parallel conjunctival folds,LIPCOF)[9]。LIPCOF是位于球结膜外侧下象限,与眼睑下缘平行的皱褶。根据LIPCOF的形态和数量进行分级:0=无永久折痕;1=单独、小的折痕;2=大于2个折痕并且高度没有超过泪河;3=很多褶皱并且高于泪河。结膜松弛多在老年干眼患者中出现,还常伴有泪溢等表现,治疗上可进行结膜松弛矫正术。
2.2.2 泪河高度
泪河高度(tear meniscus height,TMH)指泪河上下缘之间的最远垂直距离,是初步判断泪液分泌量的指标。荧光素染色后,在下睑中央拍摄泪河局部照片以测量TMH。TMH正常范围是(0.29±0.13) mm[10],TMH显著低于正常往往提示ADDE,而在轻中度MGD患者中TMH多正常或因眼表反射性泪液分泌增加而代偿性升高,在重度MGD患者中,TMH可因眼表角膜神经损伤、反射性泪液分泌受阻而降低[11]。
2.2.3 泪膜破裂时间
2017年国际泪膜和眼表协会干眼疾病工作组第2次会议(the Tear Film and Ocular Surface Society International Dry Eye Workshop II,TFOS DEWS II)[12]指出泪膜稳定性下降是干眼发病的核心环节,因此评估泪膜稳定性是干眼诊断的重要内容,泪膜破裂时间(break-up time,BUT)是干眼诊断中最常用的体征。BUT是指上一次完全眨眼至角膜上出现第1个黑点之间的时间间隔,可反映泪膜的稳定性。观测完泪河高度后,嘱患者瞬目3~4次,最后1次瞬目后自然睁眼平视,使用残存的荧光素继续测量BUT。BUT正常范围大于10 s,小于10 s考虑干眼可能,尤其在蒸发过强型干眼和VDT所致干眼中,BUT显著缩短。
2.2.4 眼表活体细胞染色
在荧光素染色状态下,继续观察眼表活体细胞染色情况。染色阳性提示角膜/结膜上皮细胞的完整性遭到破坏,我院参照中华医学会眼科学分会干眼诊疗指南,荧光素评分采用1 2分法,将眼表分为4个象限,每个象限0~3分。0=无染色;1=1~30个点状着色;2=大于30个点状着色但染色未融合;3=出现角膜点状染色融合、丝状物及溃疡等[2]。角膜点染往往提示有较为重度的干眼、炎性干眼或特殊类型干眼比如SS或眼睑闭合不全,治疗上需要加用促进角膜修复的药物。
2.2.5 睑板腺功能评估
睑板腺功能评估包括睑缘和睑板腺评估,睑板腺评估可进一步分为睑板腺开口阻塞程度和睑板腺分泌物评估。睑缘评估内容包括观察局部毛细血管扩张程度、是否存在不规整/切迹、后缘圆钝、过度角化、睫毛分布、方向是否存在异常等。睑板腺开口阻塞程度通过睑板腺分泌功能试验进行评估。按压上睑或下睑中央的五个腺体观察腺管开口有无睑板腺液排出进行分级:0=所有腺体有分泌;1=3~4个腺体有分泌;2=1~2个腺体有分泌;3=无腺体分泌[13]。睑板腺分泌物情况通过使用棉签挤压下睑缘来判断。典型MGD患者睑板腺开口常因白色角质蛋白堵塞而凸起变形,不典型MGD患者可见睑板腺的分泌物的性状改变,病变进展时睑板腺有黄色黏液样分泌物。对挤压下眼睑中央的8个睑板腺所见分泌物的性状进行评分:0 =清澈;1 =浑浊;2 =浑浊伴有碎屑;3 =粘稠呈牙膏状[13]。每个腺体单独进行评分,计分范围是0~24。MGD和睑缘炎相关干眼是干眼中最常见的一种亚型之一,治疗上比较特殊,MGD需联合眼睑按摩、强脉冲光(intense pulsed light,IPL)等治疗,睑缘炎需使用抗生素。因此,睑缘和睑板腺的评估对于干眼诊断分型和针对性治疗有帮助。
2.2.6 泪液分泌实验
根据刺激部位不同,Schirmer试验可以分为Schirmer I试验和Schirmer II试验。Schirmer I试验不刺激鼻黏膜,可进一步分为无表面麻醉和表面麻醉两种。无表面麻醉时检测的是反射性泪液分泌情况,反映主泪腺的分泌功能;表面麻醉时检测的是基础泪液分泌情况,反映的是副泪腺的分泌功能。Schirmer I试验结果小于10 mm/5 min为低分泌,小于5 mm/5 min提示干眼。Schirmer试验能够反映患者的泪液分泌量,和TMH一起可用于ADDE型干眼的辅助诊断。Schirmer II试验用棉棒刺激鼻黏膜,可反映反射性泪液分泌。Schirmer II试验可帮助鉴别SS患者,非SS患者的Schirmer II试验结果正常,而SS患者的低于正常值。
2.3 辅助检查
2.3.1 Oculus眼表综合分析仪
Oculus Keratograph 5M眼表综合分析仪(德国Oculus公司)可用于观察眼红、TMH、睑板腺数量及萎缩程度,测量BUT和评估泪膜稳定性。使用Oculus检查不具有侵入性,且可进行客观判断,不存在不同检查者之间的偏差。
眼红即结膜血管扩张,是干眼患者最直观的临床表现,同时也见于(感染性/过敏性)结膜炎、巩膜炎和翼状胬肉等眼科疾病中。基于Efron分级量表和验证的眼红分级量表(Validated Bulbar Redness grading scale,VBR),Oculus系统可自动评估眼红指数(Ocular Redness Index,ORI)[14]。
使用Oculus测量TMH ,正常范围是(0.27 ± 0.12) mm ,干眼患者的TMH平均值是(0.22±0.07) mm[15]。由于Oculus属于非侵入性辅助检查仪器,且可进行自动化评估,故Oculus测得的泪河高度相比裂隙灯更客观、准确,具有更好的定量价值。
睑板腺数量及萎缩程度的分级标准较多,我院采用睑板腺改变评分:0=无睑板腺损失;1=睑板腺损失区域小于1/3;2 =睑板腺损失区域介于1/3~2/3;3=睑板腺损失区域超过2/3[16]。0~1级属于正常范围,2~3级提示MGD所致蒸发过强型干眼可能性大。睑板腺数量及萎缩程度评估不能单独用于干眼诊断和分型,但具有辅助诊断意义。对于睑板腺萎缩较为严重者,可以使用IPL治疗辅助修复睑板腺结构。
Oculus通过观察黑白相间的Placido盘在眼表的反射,可了解角膜的曲率和屈光度,根据瞬目后角膜屈光度的变化判断BUT。相较于荧光素染色下使用裂隙灯测量BUT,Oculus具有非侵入性、干扰小、不存在观察者偏倚的优点。不同国家和地区用于诊断干眼的BUT截断值不同,我院参考TFOS DEWS II提出的诊断标准,BUT小于10 s者考虑干眼可能性大[10]。
2.3.2 共聚焦显微镜
共聚焦显微镜采用共焦激光扫描成像技术,专一探测聚焦平面反射的激光,具有良好的准直性和穿透性,分辨率高,可以连续观察角膜/结膜上皮层、基质层、内皮层等的病理变化,在细胞水平上评估眼表损害的迹象,包括角膜、结膜上皮细胞密度、结膜鳞状上皮化生及角膜神经改变等。干眼患者表现为平均单个上皮细胞面积增加,核质比和杯状细胞密度降低,基底下神经密度降低、弯曲度增加、珠状结构增多。
共聚焦显微镜是精准医疗的重要组成部分。共聚焦显微镜能够判断角膜神经情况,通过评估角膜神经的长度、直径、密度和弯曲度等,对角膜神经损伤和炎症严重程度进行判断。此外,我们前期的研究通过人工智能(artificial intelligence,AI)对干眼患者的角膜神经变化进行机器学习,能够使用A I更精准地对干眼患者的角膜神经损伤进行定量测量和分级,有助于角膜神经损伤所致干眼的诊断分型。对于有角膜神经损伤的干眼患者,治疗上可联合营养神经的药物,以促进角膜神经的修复。
共聚焦显微镜还可以通过判断炎症细胞/朗格汉斯细胞的数量和活化状态,判断患者角膜内的炎症情况,炎症细胞多提示炎性干眼或重度干眼可能性大,治疗上需加用抗炎药;炎症细胞极多者可能存在自身免疫疾病相关干眼,比如SS。我们前期的研究结合角膜神经和炎症细胞进行了干眼相关共聚焦分级,与患者的症状和体征高度相关,可以帮助判断患者的干眼严重程度,并能作为检测治疗效果和随访的指标[17]。
2.3.3 眼表造影
静脉荧光血管造影已被广泛应用于视网膜和脉络膜病理学的诊断与鉴别,近年来,由静脉荧光血管造影衍生出的眼表造影在干眼诊断中的应用逐渐引起重视。通过将具有荧光特性且能进入视网膜和脉络膜血管的造影剂注入肘中静脉,经全身血液循环,荧光素可到达眼部血管,受到蓝色波长光的激发后产生黄绿色荧光,同时用摄影机连续拍摄,可获得造影剂荧光素钠在眼表血管流动的过程。注射荧光素10 s后为血管前期,注射20 s后为血管早期,注射40 s后为血管晚期,注射3 min后为血管后期[18]。
荧光血管造影可同时显示结膜和巩膜血管,但由于巩膜组织不透明,巩膜内血管往往难以识别。正常眼表结膜血管完整无破损,表现为连贯流畅的树状分支样形态,荧光素充盈最远达角膜缘的部分毛细血管,虹膜仅显示微弱荧光。存在眼表炎症的干眼患者,血管期可见眼表血管扩张,管壁通透性增加,表现为染料渗漏;或由于新生血管形成,出现眼表异常高荧光,血管翳可延伸到角膜。虹膜炎患者可表现为虹膜荧光增强[18-19]。
2.4 病理检查
干眼的病理检查主要是指印迹细胞学检查。印迹细胞学检查简单实用,使用显微镜、免疫细胞化学、蛋白质印迹分析、聚合酶链式反应和流式细胞术等多种方法,可观察结膜鳞状化生程度和杯状细胞密度。常用于评价印迹细胞学结果的系统包括Nelson、Tseng和Blades等,我院采用Nelson分类系统:0=上皮细胞小而圆,细胞质嗜酸性染色,细胞核大,嗜碱性,核质比为1:2,杯状细胞丰富,丰满,卵圆形,细胞质PAS阳性;1=上皮细胞稍大,多角形,细胞质嗜酸性,细胞核较小,核质比为1:3,杯状细胞数量减少,但仍保持丰满的椭圆形,细胞质呈PAS阳性;2 =上皮细胞稍大,多角形,偶见多核,细胞质染色不一,细胞核较小,核质比为1:4~1:5,杯状细胞数量明显减少,体积较小,PAS阳性程度较低,细胞边界不清;3=上皮细胞稍大,多角形,细胞质嗜碱性染色,细胞核小,固缩,在许多细胞中完全不存在,核质比大于1:6,杯状细胞完全不存在[20]。Nelson分类系统可对结膜上皮细胞和杯状细胞的密度、形态、细胞质染色亲和力和细胞核/质比等进行综合分析。印迹细胞学对于诊断黏蛋白缺乏型干眼有重要指导意义。目前印迹细胞学检查还可以特异性标记某些分子(如MUC5AC),实现更精准的干眼诊断分型。MUC5AC阳性杯状细胞比例严重下降是SS比较特异的表现。
2.5 泪液炎症因子检测
炎症因子在干眼的发生和进展中具有重要作用。白介素(interleukin,IL)、趋化因子配体[chemokine(C-X-C) ligand,CXCL]、基质金属蛋白酶(matrix metalloproteinase,MMP)等炎症介质在干眼患者泪液中的表达增加,加重了眼表炎症和角膜/结膜上皮损伤程度。
干眼患者泪液中IL-1、IL-6、IL-8浓度显著升高,且与干眼严重程度相关。干眼患者泪液中IL-1浓度为正常人的2.4倍[21]。IL-6在泪液的表达水平与角膜敏感度、BUT、结膜杯状细胞密度等均具有相关性,可作为判断干眼严重程度的临床指标[22]。干眼患者泪液中CXCL8、CXCL9、CXCL10、CXCL11等趋化因子水平明显升高,趋化因子可促进T细胞向眼表功能单位的归巢,导致眼表鳞状上皮化生,加重干眼炎症和上皮损伤程度[21]。干眼患者泪液高渗状态可刺激上皮细胞表达MMP,MMP参与角膜上皮基底膜和紧密连接蛋白的降解过程。MMP活性升高可破坏角膜的屏障作用,加重干眼严重程度。LASIK术后干眼眼中MMP活性升高[23],可应用多西环素抑制MMP活性,促进角膜上皮修复。
3 依托干眼精准医疗平台的诊断和治疗
3.1 干眼的诊断
国际上,目前尚无干眼诊断的统一标准,不同地区间差异较大,我院参考TFOS DEWS II提出的标准:存在主观症状(如干燥感、异物感、烧灼感、疲劳感、不适感、视力波动等)且BUT<10 s或任何一只眼渗透压≥308 mOsm/L或双眼渗透压之差>8 mOsm/L或眼表荧光素染色阳性者,可诊断干眼。
3.2 干眼分型和治疗
干眼的病因繁多,结合病因进行诊断分型,有助于针对性地治疗原发病,同时缓解干眼症状和体征。国际上对干眼的分型多为水液缺乏型、蒸发过强型、黏蛋白缺乏型等,但由于眼表是一个整体,各组分相互影响,因此临床上患者常难以归为单一类型,所以这种传统的分型对于治疗的帮助和指导意义有限。根据我们前期的临床观察和总结,发现是否具有眼表炎症对于患者的治疗和预后影响较大,因此根据眼表共聚焦显微镜下是否观察到朗格罕细胞,开创性地将干眼区分为炎性干眼和非炎性干眼(图2),明显异物感等症状或结膜充血等体征也对炎性干眼具有提示意义。
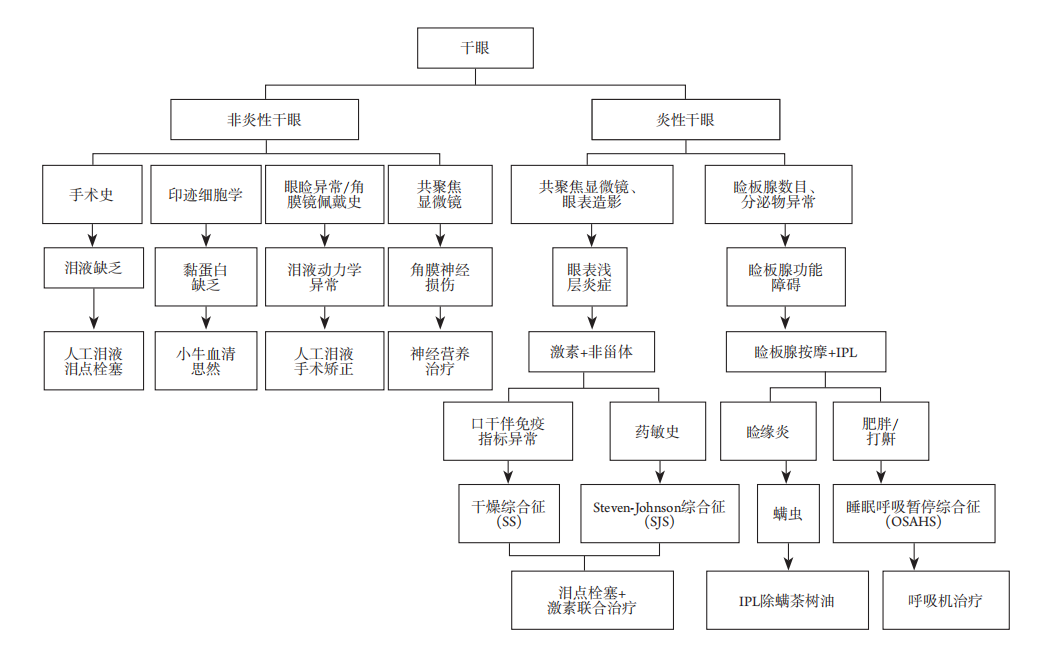

图 2 基于干眼类型的治疗
Figure 2 Treatment based on dry eye type
3.2.1 炎性干眼
对于炎性干眼,根据共聚焦显微镜检查结果和睑板腺数量、分泌物情况进行分类。
若使用共聚焦显微镜检查可见较多朗格罕细胞,眼表造影见荧光素渗漏或新生血管等异常征象,则考虑为眼表浅层炎症所致干眼,给予糖皮质激素或非甾体类抗炎药治疗;炎症较重者,应联合弱效激素或免疫抑制剂抑制炎症反应,促进角膜上皮修复。疗效不佳者回顾病史,若同时存在口干、关节痛等症状,可进行免疫指标检查(SSA、SSB、ANA、RF、SP1、CA6、PSP),免疫指标存在异常者提示SS,应采用激素联合泪点栓塞治疗;若存在药敏史,考虑SJS,治疗基本同SS。
若仅存在睑板腺数目减少或分泌物性、质的改变,提示MGD,应强调睑板腺按摩联合IPL治疗。本课题组前期研究[24]证实:IPL可通过升高治疗区温度改善睑板腺分泌,同时能破坏MGD患者眼睑边缘的毛细血管扩张,从而减少眼睑组织中的炎症因子,改善干眼症状。若睑板腺功能评估存在异常,且裂隙灯下观察存在睑缘炎,应考虑MGD合并螨虫,需加用除螨茶树油。询问病史,打鼾或肥胖患者应考虑OSAHS所致干眼,予以呼吸机治疗。
3.2.2 非炎性干眼
对于非炎性干眼,根据体征和辅助检查结果进行进一步分型。
若Schirmer试验结果显著低于正常值,考虑ADDE,给予人工泪液治疗,必要者进行泪点栓塞。若存在准分子激光角膜切削术(photorefractive keratectomy,PRK)、LASIK等降低角膜敏感性的手术史,也应考虑ADDE。此类患者病程较短,角膜敏感性恢复后干眼症状可自行缓解,常规仅予以人工泪液治疗,严重者进行泪点栓塞。
若印迹细胞学检查杯状细胞明显减少,考虑黏蛋白缺乏性干眼,给予小牛血清或不含防腐剂的人工泪液,联合促进黏蛋白分泌及杯状细胞生长的药物治疗。
若存在眼睑异常(如缺损、内外翻等),诊断为泪液动力学(分布)异常。应根据病情把握眼睑重建的手术时机,积极进行矫正,同时使用人工泪液辅助治疗。若存在角膜接触镜长期佩戴史,考虑可能是瞬目减少造成的泪液动力学异常,应指导患者减少角膜接触镜的使用,必要时滴加人工泪液。
若共聚焦显微镜检查显示神经密度降低、弯曲度增加或直径增加,甚至出现珠状结构增多,应考虑角膜神经损伤所致干眼,除干眼对症治疗外,需进行神经营养治疗。本课题组前期研究证实,在眼表雾化使用维生素B12对改善干眼症症状和体征有较好的疗效,治疗3个月后患者BUT显著升高,基底上皮细胞密度增加[25]。口服维生素B1和甲钴胺片可减轻干眼症状,如干涩感、疼痛、畏光等,治疗2个月后BUT有显著改善,角膜神经纤维密度明显增加[26]。
3.3 干眼严重程度和治疗
除了对干眼进行病因分型外,对干眼的严重程度进行精准评估和分级也有助于为患者进行个性化的治疗,随访患者治疗效果与疾病进展情况(图3)。干眼的严重程度依据主观症状和角结膜染色的严重程度进行评估。轻度主观症状、无角结膜荧光素染色属于轻度干眼;中重度主观症状、有角结膜荧光素染色,但经过治疗后体征可消失,属于中度干眼;中重度主观症状、角结膜荧光素染色明显,治疗后体征不能完全消失,属于重度干眼[2]。
轻度干眼应进行患者指导,强调改善用眼习惯、环境及饮食,减少或停用有不良作用的全身或局部药物,使用眼睑物理治疗(如眼睑清洁、热敷及睑板腺按摩等),必要时滴加人工泪液。中度干眼需在轻度干眼治疗方案的基础上增加使用湿房镜或硅胶眼罩以及局部抗炎治疗,所选人工泪液的黏稠度应高于轻度干眼,必要者行泪点栓塞。重度干眼需将中度干眼治疗方案中的局部抗炎治疗调整为全身抗炎治疗,增加口服刺激泪液分泌药物和自家血清,使用治疗性角膜接触镜,极其严重者需考虑手术治疗(如永久性泪小点封闭、睑缘缝合术、眼睑手术、颌下腺移植手术等)。
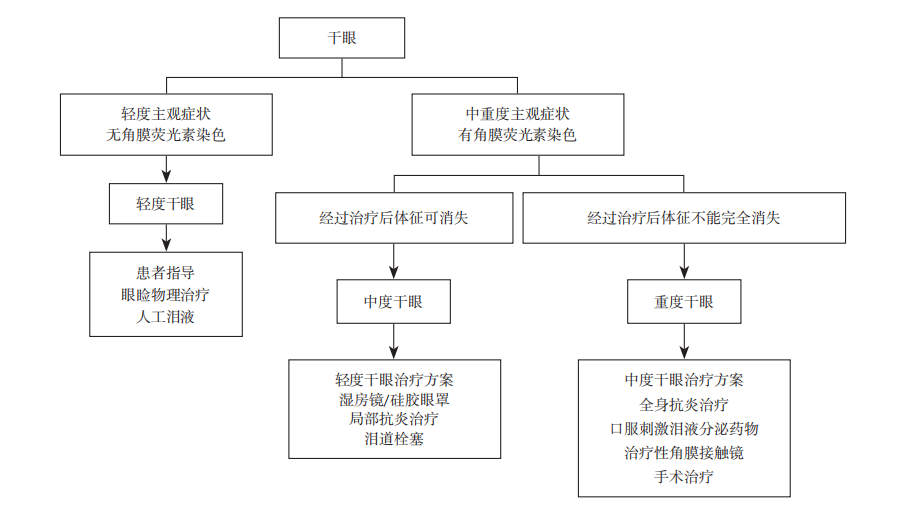

图3 基于干眼严重程度的治疗
Figure 3 Treatment based on dry eye severity
4 病例展示
患者,女,3 9岁,因“双眼眼干半年,加重2个月”于2017年2月15日就诊于我院。患者自述于半年前无明显原因出现双眼干涩、异物感、疲劳感,偶有畏光、迎风流泪,无口干、关节痛、睡眠时呼吸困难。于当地医院就诊,予托百士治疗,疗效不佳,2个月前眼干加重,频发畏光、迎风流泪。否认药物过敏及全身皮疹病史。否认眼部疾病史、手术史及用药史。OSDI 17分(表1)。
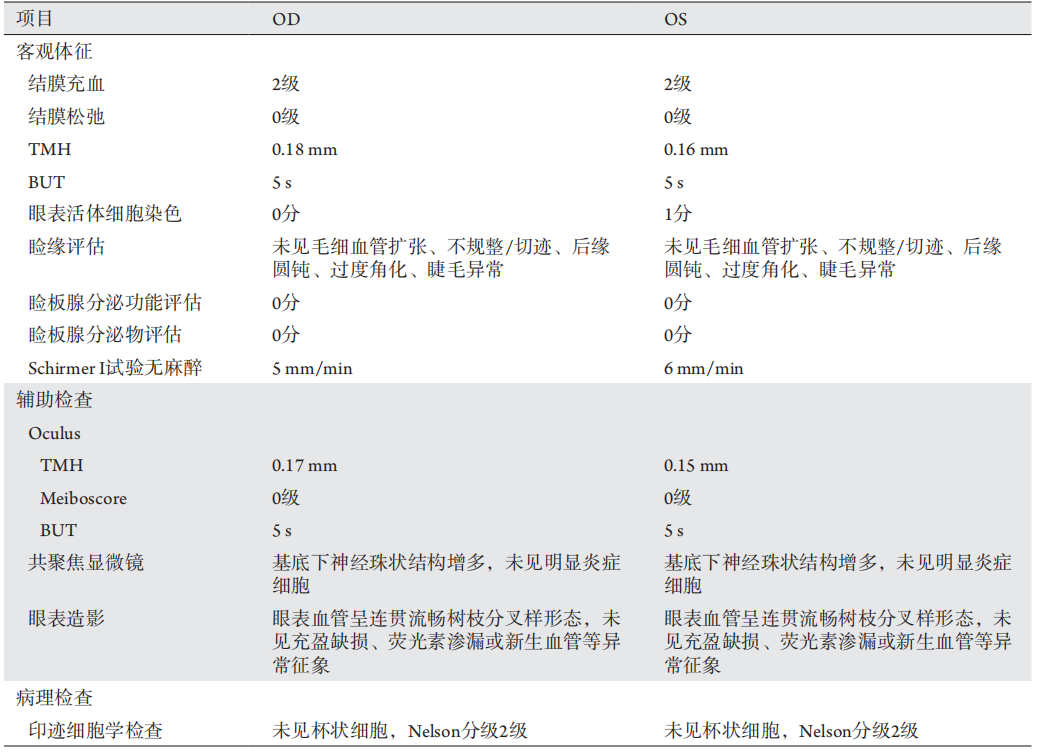
表1 体征及辅助检查结果
Table 1 Physical signs and auxiliary examination results

诊断:右眼非炎性干眼,黏蛋白缺乏性干眼(轻度);左眼非炎性干眼,黏蛋白缺乏性干眼(中度)。诊断依据:1)患者存在双眼干涩、异物感等干眼症状,OSDI评分>12,双眼BUT均低于正常值,眼表活体细胞染色OD 0分,OS 1分(图4),因此可诊断为右眼干眼(轻度)左眼干眼(中度);2)眼表共聚焦显微镜未见明显炎症细胞浸润(图5),眼表造影未见充盈缺损、荧光素渗漏或新生血管等异常征象(图6),因此双眼均为非炎性干眼;3)患者Schirmer试验结果正常,且睑缘及睑板腺功能正常,因此暂排除ADDE及MGD型干眼;4)患者双眼印迹细胞检查未见杯状细胞(图7),因此可诊断为双眼黏蛋白缺乏型干眼。
治疗:对于黏蛋白缺乏型干眼,思然(聚乙二醇滴眼液)能够模拟分泌型黏蛋白在眼表形成网状结构,使双重润滑剂聚乙二醇和丙二醇持久滞留于眼表,显著高于其他人工泪液的眼表停留时间,有效缓解干眼症状。给予患者聚乙二醇滴眼液双眼点眼治疗,每日4~5次。2周后复查,患者自述症状明显改善,双眼干涩、异物感、疲劳感减轻,OSDI 11分,BUT OD 8 s,OS 7 s,左眼角膜点染消失,眼表活体细胞染色OD 0分,OS 0分。
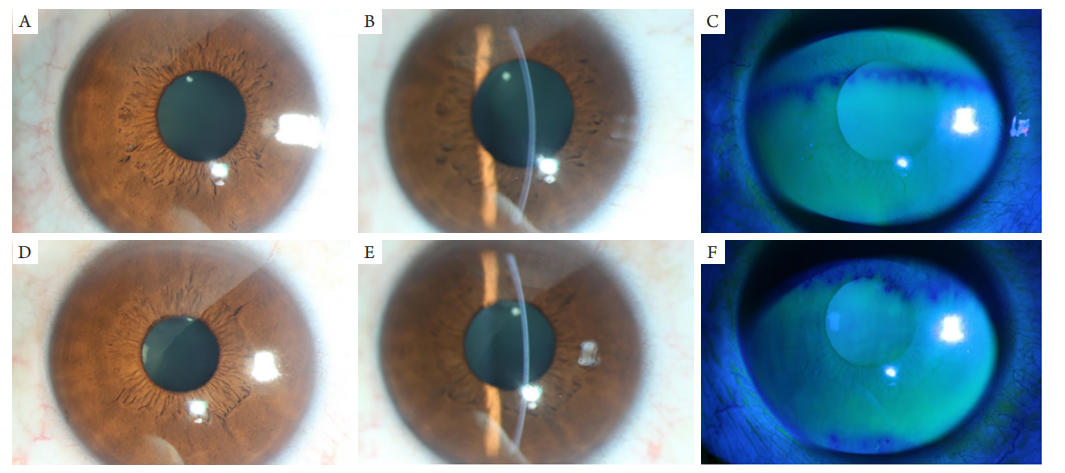
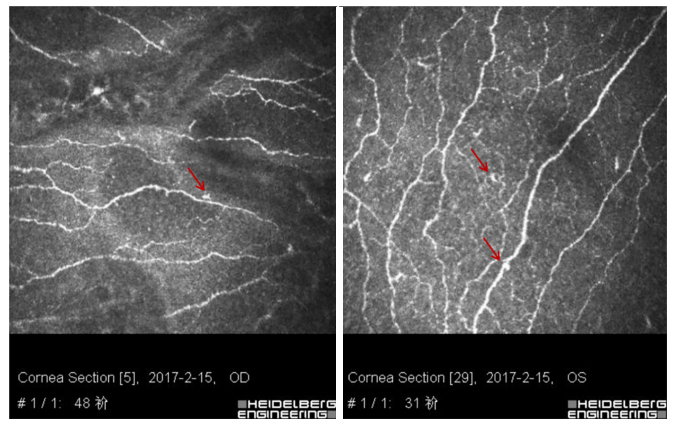
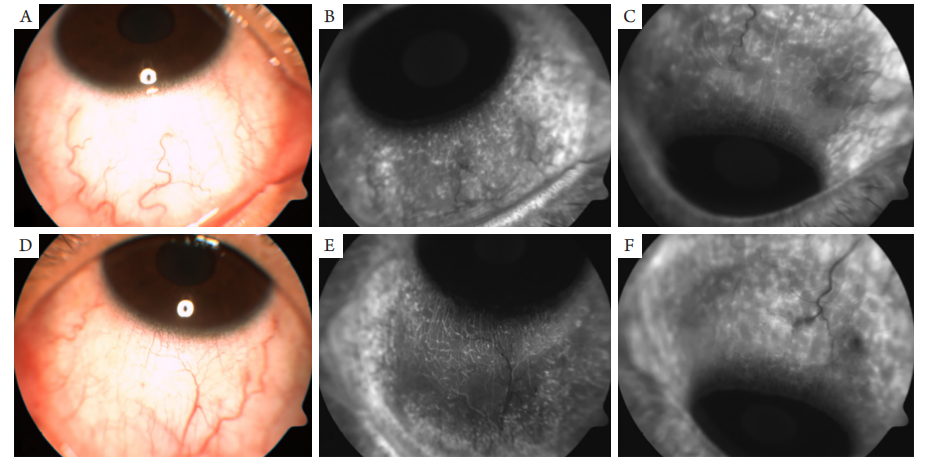
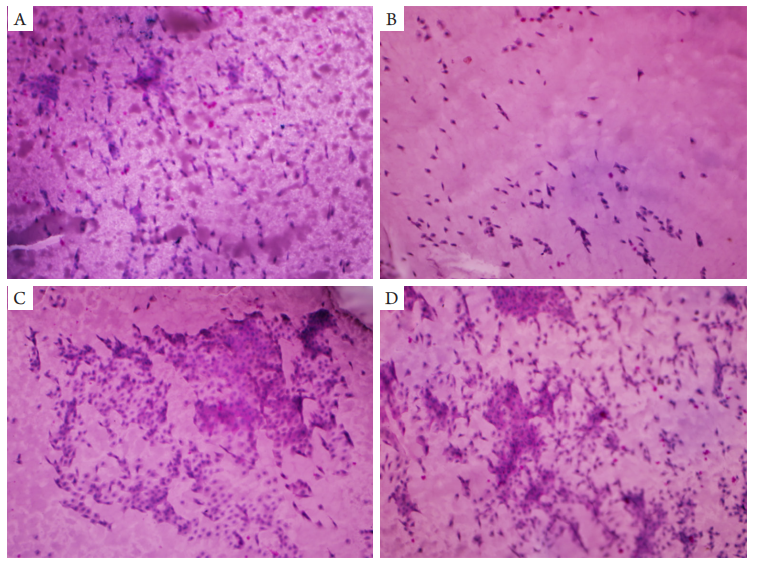

图4 前节彩照
Figure 4 Color photos of the front segment
(A~C)OD;(D~F)OS。左眼颞侧下象限可见5个点状着色。
(A–C) OD; (D–F) OS. 5 punctate stains can be seen in the lower temporal quadrant of the left eye.

图5 共聚焦显微镜
Figure 5 Confocal microscope
基底下神经珠状结构增多,未见明显炎症细胞(红色箭头示增多的珠状结构)。
The number of sub-basal nerve beads increased, no obvious inammatory cells were found (the red arrow shows the increased beaded structure).

图6 眼表造影
Figure 6 Ocular surface angiography
(A~C)OD;(D~F)OS。眼表血管未见充盈缺损,荧光素渗漏或新生血管等异常征象。
(A–C) OD; (D–F) OS. There is no filling defect, fluorescein leakage or neovascularization.

图7 印迹细胞学检查
Figure 7 Impression cytology
(A)鼻侧OD(×100);(B)鼻侧OS(×100);(C)颞侧OD(×200);(D)颞侧OS(×200)。双眼鼻、颞侧均未见杯状细胞,Nelson分级2级。
(A) Nasal OD (×100), (B) nasal OS (×100); (C) temporal OD (×200); (D) temporal OS (×100). No goblet cells were found in the nasal and temporal sides of both eyes, with Nelson grade 2.
5 结语
传统的干眼诊疗具有一定的局限性。其检查手段相对单一,且大多通过检查者主观判断,缺乏检查者之间的可重复性。检查过程具有侵入性,往往引起泪液的反射性分泌,影响了检查结果的准确性。传统检查项目偏重于客观体征,不利于进行细致的病因分型,治疗缺乏针对性。我院干眼精准医疗平台通过引进共聚焦显微镜、泪液炎症因子检测等技术手段,大力发展A I自动识别测量技术,通过自动化或非侵入性测量提高检查的准确性,在更为客观的定量检测基础上,实现了针对干眼病因的诊断分型和严重程度分级。临床实践中,我们开创性地将干眼分为炎性干眼和非炎性干眼,有效结合检查结果,针对不同病因的干眼制定了个性化的治疗方案,提高了治疗的有效性。
近年来,越来越多的研究关注于细菌菌群与干眼之间的关系。我们的前期研究证实,MGD的严重程度与微生物群之间具有相关性。随着MGD严重程度的增加,微生物组分变得更加复杂,细菌丰度增加。我们尝试提出了一个新的细菌严重程度分级系统,该系统能够辅助评估MGD的严重程度[27]。在后续研究中,我们希望明确细菌菌种与MGD严重程度以及干眼不同类型之间的关系,找出致病的关键菌种,建立依据眼表微生物菌群对干眼进行微生物学分型的标准,以期从微生物学的角度实现干眼的精确诊断和个性化治疗。
目前,炎症环路在干眼发病机制中的地位已获得学界的认可,但炎症因子相关检测在干眼诊断和分型中的应用还在探索研究中。在今后的临床实践与科研中,我们也将致力于探索眼表泪液炎症因子检测在干眼分子分型中的诊断价值,完善我院干眼精准医疗平台建设,推动精准医疗在干眼领域的应用和发展。
基金
1. 首都卫生发展科研专项项目 (2018-2-4093)。
This work was supported by the Capital Health Development Research Project, China (2018-2-4093).
This work was supported by the Capital Health Development Research Project, China (2018-2-4093).
参考文献
1. Stapleton F, Alves M, Bunya VY, et al. TFOS DEWS II Epidemiology
Report[ J]. Ocul Surf, 2017, 15(3): 334-365.
2. 中华医学会眼科分会角膜病学组。干眼临床诊疗专家共识
(2013年)[ J]. 中华眼科杂志, 2013, 49(1): 73-75.
Keratology Group, Ophthalmology Branch, Chinese Medical Association. Expert consensus on clinical diagnosis and treatment of dry eye (2013)[ J]. Chinese Journal of Ophthalmology, 2013, 49(1): 73-75.
Keratology Group, Ophthalmology Branch, Chinese Medical Association. Expert consensus on clinical diagnosis and treatment of dry eye (2013)[ J]. Chinese Journal of Ophthalmology, 2013, 49(1): 73-75.
3. National Research Council (US) Committee on A Framework for
Developing a New Taxonomy of Disease. The national academies
collection: reports funded by national institutes of health. toward
precision medicine: building a knowledge network for biomedical
research and a new taxonomy of disease[M]. Washington (DC):
National Academies Press (US), 2011.
4. 付文华, 钱海利, 詹启敏. 中国精准医学发展的需求和任务[ J].
中国生化药物杂志, 2016, 36(4): 1-4.
FU WH, QIAN HL, ZHAN QM. Precision medicine in china[ J]. Chinese Journal of Biochemical Pharmaceutics, 2016, 36(4): 1-4.
FU WH, QIAN HL, ZHAN QM. Precision medicine in china[ J]. Chinese Journal of Biochemical Pharmaceutics, 2016, 36(4): 1-4.
5. Terry SF. Advancing the precision medicine initiative[ J]. Cancer
Discov, 2015, 5(12): 1230.
6. 孙晓东, 朱鸿. 重视精准医疗在眼科临床实践中的应用[ J]. 中华
眼科杂志, 2016, 52(2): 85-88.
SUN XD, ZHU H. Emphasis on the application of precision medicine in ophthalmology[ J]. Chinese Journal of Ophthalmology, 2016, 52(2): 85-88.
SUN XD, ZHU H. Emphasis on the application of precision medicine in ophthalmology[ J]. Chinese Journal of Ophthalmology, 2016, 52(2): 85-88.
7. Ozcura F, Aydin S, Helvaci MR. Ocular surface disease index for the
diagnosis of dry eye syndrome[ J]. Ocul Immunol Inflamm, 2007,
15(5): 389-393.
8. Institute of Eye Research. IER Grading Scales[M]. Sydney, Australia:
Institute for Eye Research, 2007.
9. H?h H, Schirra F, Kienecker C, et al. Lid-parallel conjunctival folds
are a sure diagnostic sign of dry eye[ J]. Ophthalmologe, 1995,
92(6): 802-808.
10. Wolffsohn JS, Arita R, Chalmers R, et al. TFOS DEWS II diagnostic
methodology report[ J]. Ocul Surf, 2017, 15(3): 539-574.
11. Bron A J, de Paiva CS, Chauhan SK , et al. TFOS DE WS II
pathophysiology report[ J]. Ocul Surf, 2017, 15(3): 438-510.
12. Craig JP, Nichols KK, Akpek EK, et al. TFOS DEWS II definition and
classification report[ J]. Ocul Surf, 2017, 15(3): 276-283.
13. Lekhanont K, Jongkhajornpong P, Sontichai V, et al. Evaluating dry eye
and meibomian gland dysfunction with meibography in patients with
Stevens-Johnson syndrome[ J]. Cornea, 2019, 38(12): 1489-1494.
14. Amparo F, Wang H, Emami-Naeini P, et al. The Ocular Redness Index:
a novel automated method for measuring ocular injection[ J]. Invest
Ophthalmol Vis Sci, 2013, 54(7): 4821-4826.
15. Tian L, Qu JH, Zhang XY, et al. Repeatability and reproducibility of
noninvasive keratograph 5M measurements in patients with dry eye
disease[ J]. J Ophthalmol, 2016, 2016: 8013621.
16. Arita R, Itoh K, Inoue K, et al. Noncontact infrared meibography to
document age-related changes of the meibomian glands in a normal
population[ J]. Ophthalmology, 2008, 115(5): 911-915.
17. Liu Y, Chou Y, Dong X, et al. Corneal subbasal nerve analysis using in
vivo confocal microscopy in patients with dry eye: analysis and clinical
correlations[ J]. Cornea, 2019, 38(10): 1253-1258.
18. Mitsui Y, Matsubara M, Kanagawa M. Fluorescence irido-corneal
photography[ J]. Br J Ophthalmol, 1969, 53(8): 505-512.
19. Meyer PA, Watson PG. Low dose fluorescein angiography of the
conjunctiva and episclera[ J]. Br J Ophthalmol, 1987, 71(1): 2-10.
20. Nelson JD, Havener VR, Cameron JD. Cellulose acetate impressions of
the ocular surface. Dry eye states[ J]. Arch Ophthalmol, 1983, 101(12):
1869-1872.
21. 克里木江, 柯碧莲. 干眼病的眼表炎症机制研究进展[ J]. 世界临
床药物, 2012, 33(7): 426-430.
KELI MJ , KE BL. Recent progress in ocular surface inflammatory pathogenesis of dry eye disease[ J]. World Clinical Drugs, 2012, 33(7): 426-430.
KELI MJ , KE BL. Recent progress in ocular surface inflammatory pathogenesis of dry eye disease[ J]. World Clinical Drugs, 2012, 33(7): 426-430.
22. Yoon KC, De Paiva CS, Qi H, et al. Expression of Th-1 chemokines
and chemokine receptors on the ocular surface of C57BL/6 mice:
effects of desiccating stress[ J]. Invest Ophthalmol Vis Sci, 2007,
48(6): 2561-2569.
23. Sambursky R, O'Brien TP. MMP-9 and the perioperative management
of LASIK surgery[ J]. Curr Opin Ophthalmol, 2011, 22(4): 294-303.
24. Wei S, Ren X, Wang Y, et al. Therapeutic effect of intense pulsed
light (IPL) combined with meibomian gland expression (MGX) on
meibomian gland dysfunction (MGD)[ J]. J Ophthalmol, 2020, 2020:
3684963.
25. Yang J, Liu Y, Xu Y, et al. A new approach of ocular nebulization with
vitamin B12 versus oxytocin for the treatment of dry eye disease: an
in vivo confocal microscopy study[ J]. Drug Des Devel Ther, 2019, 13:
2381-2391.
26. Ren X , Chou Y, Jiang X , et al. Effects of oral vitamin B1 and
mecobalamin on dry eye disease[ J]. J Ophthalmol, 2020, 2020:
9539674.
27. Jiang X, Deng A, Yang J, et al. Pathogens in the Meibomian gland
and conjunctival sac: microbiome of normal subjects and patients
with Meibomian gland dysfunction[ J]. Infect Drug Resist, 2018,
11: 1729-1740.
施引文献
1. 陈珏静,廖颖琳,梁凌毅.儿童眼移植物抗宿主病诊治进展[J].器官移植,2022,13(2):253-257.