越橘提取物对 RPE 细胞氧化损伤和血管生成的抑制作用
阅读量:3661
DOI:10.12419/24040602
发布日期:2024-02-28
作者:
刘晓雯 ,曹琛 ,苏映雪 ,王延东
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
越橘提取物
氧化损伤
血管生成
年龄相关性黄斑变性
摘要
目的:探讨越橘提取物对视网膜色素上皮(retinal pigment epithelial,RPE)细胞氧化损伤和血管生成的抑制作用。方法:① 将人RPE细胞(ARPE-19)分为对照组、模型组、越橘提取物组,模型组给予0.5 mmol/L3-吗啉代亚胺 (3 morpholinosydnonimine,SIN-1)处理24 h,越橘提取物组给予10ng/mL越橘提取物处理1h 后,再给予0.5 mmol/L SIN-1处理24 h。细胞活性检测法(Cell Counting Kit-8,CCK-8)测定各组细胞活性,流式细胞术检测细胞活性氧(reactive oxygen species,ROS)水平。②将人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)分为对照组、模型组、越橘提取物组,模型组给予10 ng/mLVEGF处理8 h,越橘提取物组给予10 ng/mL越橘提取物处理12 h后,再给予10 ng/mLVEGF处理8 h。划痕实验和Transwell实验检测细胞迁移和侵袭,管腔形成实验检测细胞血管生成情况。结果:①越橘提取物在质量浓度≤10 ng/mL对 ARPE-19细胞无明显毒性。给予SIN-1处理后,ARPE-19细胞活性明显降低,而预孵10 ng/mL越橘提取物
可使细胞活性恢复接近至正常(P<0.001),后续实验均选用该浓度。同时,越橘提取物可降低SIN-1诱导的ARPE-19细胞内ROS水平(P<0.0001)。②给予VEGF处理后,HUVEC细胞迁移和侵袭能力增强,而预孵越橘提取物可使细胞迁移和侵袭能力减弱(P<0.0010)。同时,越橘提取物可抑制VEGF诱导的HUVEC细胞小管形成(P<0.0001)。结论:越橘提取物具有较强的抗氧化能力和抗血管生成活性,为其作为潜在治疗年龄相关性黄斑变性治疗药物提供了科学依据。
全文
文章亮点
1. 关键发现
越橘提取物可降低视网膜色素上皮细胞中 ROS 水平,恢复膜色素上皮细胞活力,同时抑制 VEGF 引起的血管生成。
2. 已知与发现
目前临床上年龄相关性黄斑变性一线治疗手段抗 VEGF 生物制剂疗法存在作用时间短、分解快,停药后容易复发等不足,无法满足临床需求。
越橘提取物可提高 SIN-1 诱导的视网膜色素上皮细胞活性,降低细胞内 ROS 水平,减弱 VEGF 诱导细胞迁移和侵袭,抑制细胞小管形成。
3. 意义与改变
越橘提取物具有较强的抗氧化能力和抗血管生成活性,为其作为潜在年龄相关性黄斑变性治疗药物提供了科学依据。
年龄相关性黄斑变性(age-related macular degeneration, AMD)是老年人群低视力乃至失明的主要原因,2040年全球AMD患者数量预计将达到3亿人,成为第三大致盲性眼病[1]。视网膜色素上皮(retinal pigment epithelial, RPE)氧化损伤和新生血管生成是AMD的主要病理特征。目前国内外诊疗指南一致推荐AMD首选抗血管内皮生长因子(vascular endothelial growth factor,VEGF)生物制剂疗法。但是,抗VEGF药物的作用时间短、分解快,停药后容易再次复发,需要多次注射,还有约50%患者对抗VEGF疗法反应欠佳[2]。因此,临床上亟需寻找防治AMD的其他种类新药。越橘提取物是一种纯化的越橘花青素提取物,其由新鲜越橘经醇提取、随后浓缩并最终色谱纯化到吸附剂大交联树脂上得到,主要活性成分花青素具有抗肿瘤、预防糖尿病、改善视力以及保护神经和心脏等多种药理作用[3-4]。本研究采用体外诱导的RPE细胞氧化损伤和内皮细胞血管生成模型,探讨越橘提取物对氧化损伤和血管生成的抑制作用。
1 材料与方法
1.1 主要试剂和仪器
越橘提取物(法国Ferlux Mediolanum SA公司, 202800),用二甲基亚砜(dimethyl sulfoxide,DMSO)稀释成10 mg/mL作为储备液;3-吗啉代亚胺(3-morpho linosydnonimine,SIN-1)(日本 Dojindo公司,S264);VEGF (德国Merck公司,V7259);酶标仪 (美国BioTek公司,ELX800);流式细胞仪 (美国Thermo Fisher公司,A24858);光学显微镜 (日本Olympus公司,CKX41)。
1.2 细胞系与细胞培养
人视网膜色素上皮细胞(ARPE-19)细胞系来自美国菌种保藏中心(American Type Culture Collection,ATCC),ARPE-19细胞系在高糖培养基中培养,该培养基含有10%胎牛血清(Gibco)和1%青霉素-链霉素(Gibco)。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)细胞系来自ATCC,在内皮细胞培养基中培养,该培养基含有5%胎牛血清、1%血管内皮细胞生长补充和1%青霉素-链霉素。细胞系在37℃、含5% CO2的加湿培养箱中培养。
1.3 方法
1.3.1 试验分组及处理
(1)将培养的细胞分为3组:对照组、模型组(SIN-1处理)、越橘提取物组。其中,SIN-1处理浓度为0.5 mmol/L,越橘提取物质量浓度均为10 ng/mL,越橘提取物组是先使用越橘提取物预孵育1 h后再加入SIN-1。
(2)将培养的ARPE-19细胞分为3组:对照组、模型组(VEGF处理)、越橘提取物组。其中,VEGF处理质量浓度为10 ng/mL,越橘提取物质量浓度均为10 ng/mL,模型组予VEGF处理8 h,越橘提取物组先使用越橘提取物预孵育12 h后再加入VEGF并进行细胞侵袭试验和血管形成试验。
1.3.2 细胞活力检测
将ARPE-19细胞接种于96孔细胞培养板中,密度为每孔10 000个细胞。24 h后,用SIN-1(或与越橘提取物联合)处理细胞,在细胞培养箱中培养24h,然后将细胞计数试剂-8(Cell Counting Kit-8,CCK-8)加入96孔板中,37 ℃孵育1~4 h。用微孔板仪(FLUOstar Omega-ACU)测定细胞活力,获得450 nm处的吸收光度(optical density,OD)值。生长率计算为:细胞活力=[A(处理)-A(空白)]/[A(对照组)-A(空白)]×100%。
1.3.3 细胞内活性氧(reactive oxygen species,ROS)水平检测
将ARPE-19细胞接种于6孔细胞培养板中,密度为每孔200 000个细胞。用SIN-1(或与越橘提取物联合)处理细胞,在细胞培养箱中培养24 h。随后去除培养基,以5 μmol/LC11-BODIPY581/591与细胞在37 ℃无血清培养基中避光孵育30 min,磷酸盐缓冲液洗涤,617 nm滤光片在流式细胞仪上分析ROS水平,每个样本至少收集10 000个细胞的数据。
1.3.4 细胞迁移试验
将HUVEC接种于6孔细胞培养板上,单层培养24h(100%汇合)。用无菌移液管尖端垂直穿过孔中心在细胞单层上划痕。用温PBS洗去浮细胞。用SIN-1(或与越橘提取物联合)处理HUVEC。伤后0、8 h显微镜下成像。为了排除细胞增殖的影响,加入1.0 mg/L丝裂霉素(Sigma)。
1.3.5 细胞侵袭试验
带8 μm孔过滤器的Transwell室(Corning)预涂1 g/L Matrigel (BD Biosciences)。HUVEC饥饿过夜后加入上室,每孔50 000个细胞,下室填满VEGF培养基(或与越橘提取物联合)。24 h后,将细胞浸入3%多聚甲醛溶液中15 min,结晶紫染色,显微镜下计数。
1.3.6 血管形成试验
将HUVEC接种到预先包被基底膜基质( B D Biosciences)的96孔细胞培养板上,每孔10 000个细胞。然后用VEGF(或与越橘提取物联合)处理细胞8 h。在显微镜下拍摄血管形成。
1.4 统计学方法
采用SPSS 26.0软件进行统计分析。所有实验数据均以(x±s)表示,组间数据比较采用方差分析。以P<0. 05为差异有统计学意义。
2 结果
2.1 越橘提取物可减少氧化应激引起的ARPE-19细胞损伤
使用不同浓度的SIN-1处理ARPE-19细胞并及进行细胞活力检测,结果显示,浓度为0.25 mmol/L及以上的SIN-1处理后可导致ARPE-19细胞损伤(图1A)。同时使用不同浓度的越橘提取物处理ARPE-19细胞以测试其毒性,结果显示质量浓度低于10 ng/mL的越橘提取物对ARPE-19细胞无明显毒性(图1B),故选0.5 mmol/LSIN-1和1、3、10 ng/mL的越橘提取物进行后续实验。与模型组细胞存活率(70.84±3.89)%相比,使用不同浓度(1、3、10 ng/mL)的越橘提取物分别处理经SIN-1诱导的ARPE-19细胞,细胞存活率分别提高到(81.37±4.97)%、(87.97±2.92)%、(92.06±1.88)%,越橘提取物可呈剂量依赖性减少氧化应激引起的ARPE-19细胞活力损伤 (图1C)。
2.2 越橘提取物可降低SIN-1诱导的ARPE-19细胞ROS水平
本研究使用不同浓度的越橘提取物处理经0.5 mmol/L SIN-1诱导氧化的ARPE-19细胞,并用流式细胞仪检测处理后细胞内的ROS水平。结果显示,SIN-1可诱导ARPE-19细胞内ROS水平升高,越橘提取物可降低SIN-1诱导的ARPE-19细胞内ROS水平(图2),显示出明显的抗氧化应激效果。
2.3 越橘提取物可抑制VEGF诱导的HUVEC迁移和侵袭
结果显示VEGF可增加HUVEC的迁移能力,越橘提取物可降低VEGF引起的细胞迁移 (图3A、B)。同时,细胞侵袭试验结果显示,VEGF可提高HUVEC的侵袭能力,越橘提取物可减弱VEGF引起的细胞侵袭能力 (图3C、D)。
2.4 越橘提取物可抑制VEGF诱导的HUVEC血管形成
血管生成试验结果显示,VEGF可增加HUVEC血管形成,越橘提取物可抑制VEGF诱导的血管生成(图4)。
3 讨论
AMD是一种进行性退行性眼部疾病,是老年人严重视力丧失的主要原因之一[5],主要由视网膜黄斑破裂引起。晚期AMD严重影响视力,并进一步影响患者日常活动。AMD可分为两种类型:干性AMD (85%~90%)和湿性AMD(10%~15%)[6],其中大多数干性AMD患者最终都会进展为湿性AMD。湿性AMD主要表现为脉络膜血管侵入视网膜下构成脉络膜新生血管,发生视网膜下的出血、滲出等病理性改变,对视网膜色素上皮细胞及视细胞造成损害。
氧化应激诱导的RPE损伤被认为是AMD发病的关键因素。RPE是一种色素沉着的单层,在维持视网膜功能方面起着关键作用,如营养物质运输、形成外部血液视网膜屏障以阻止水和离子的通过、光感受器外段尖端的吞噬作用以及视觉色素的再生等[7-8]。RPE含有满足能量需求所需的高密度线粒体,因此严重刺激会导致线粒体功能障碍和ROS的过量产生,从而进一步引发氧化应激相关的级联反应。当RPE细胞暴露于外源性氧化应激源,包括紫外线、电离辐射或香烟烟雾时,细胞中会产生过量的ROS,导致氧化还原系统失衡,导致细胞脂质、蛋白质和核酸的氧化损伤。此外,衰老是诱发RPE氧化应激损伤的一个重要因素[9-10]。随着年龄的增长,RPE中功能失调的线粒体数量增加,导致ROS生成增加[11-12]。
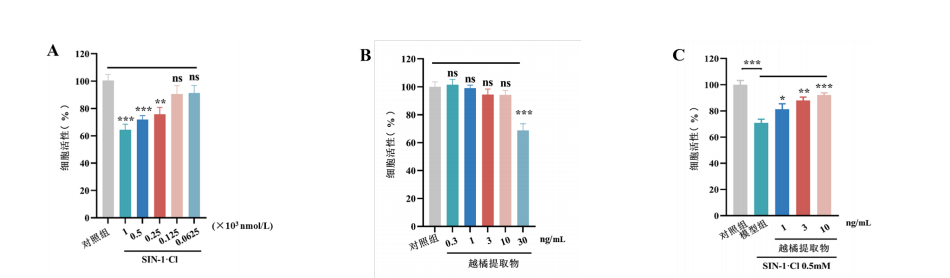
图1 越橘提取物可减少SIN-1诱导的ARPE-19细胞损伤
Figure1 Bilberry extract can decrease SIN-1 induced damage in ARPE-19 cells
(A)不同浓度SIN-1对ARPE-19细胞活力的影响;(B) 不同浓度越橘提取物对ARPE-19细胞活力的影响;(C) 不同浓度越橘提取物对SIN-1处理后ARPE-19细胞活力的影响。组间比较,(A) (B)图与对照组比,(C)图与模型组比较,n=6,***表示P值<0.001 ,**表示P值<0.01 ,*表示P值<0.05。
(A) Effects of different concentrations of SIN-1 on the viability of ARPE-19 cells; (B) Effects of different concentrations of bilberry extract on the viability of ARPE-19 cells; (C) Effects of different concentrations of bilberry extract on the viability of ARPE-19 cells treated with SIN-1. (A) (B) compared with control group, (C) compared with model group, n=6, where *** means P <0.001 , ** means P <0.01 and * means P< 0.05.
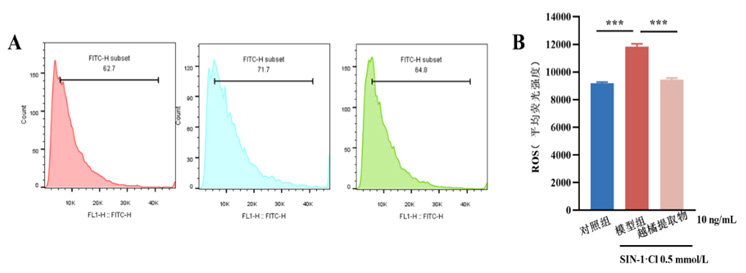
图2 越橘提取物可降低SIN-1诱导的ARPE-19细胞内ROS水平
Figure 2 Bilberry extract can reduce the intracellular ROS levels in ARPE-19 cells induced by SIN-1
(A)越橘提取物对SIN-1处理后ARPE-19细胞内ROS水平的影响;(B) ROS平均荧光强度定量。组间比较,与模型组比较,n=6,****P<0.000 1。
(A) Effects of bilberry extract on intracellular ROS levels in ARPE-19 cells treated with SIN-1; (B) Quantitative measurement of average ROS fluorescence intensity. Compared with model group, n=6, where **** means P <0.000 1.
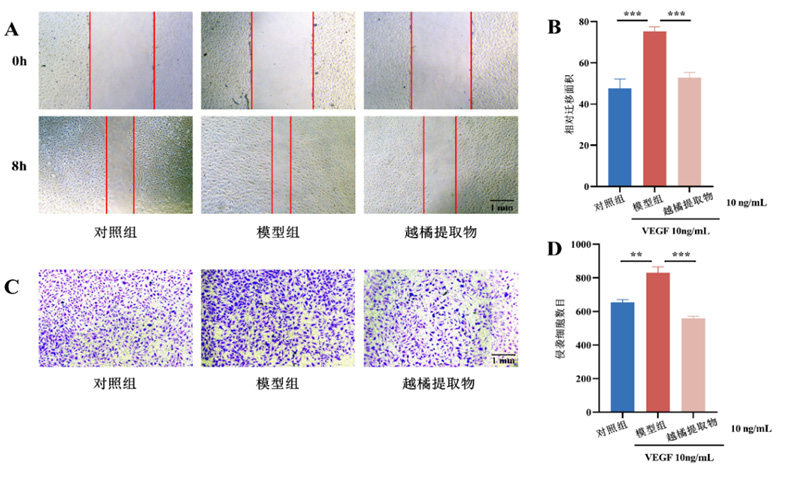
图3 越橘提取物可抑制VEGF诱导的HUVEC迁移和侵袭
Figure 3 Bilberry extract can inhibit migration and invasion of HUVE Cinduced by VEGF
(A)越橘提取物对VEGF处理后的HUVEC迁移能力的影响(x4);(B)细胞迁移试验定量结果;(C)越橘提取物对VEGF处理后的HUVEC侵袭能力的影响(x4);(D)细胞侵袭试验定量结果。组间比较,与模型组比较,n=6,***P<0.001 0,**P<0.01。
(A) Effects of bilberry extract on the migration of HUVECs treated with VEGF(x4); (B) Quantitative results of cell migration test; (C) Effects of bilberry extract on the invasion of HUVECs treated with VEGF(x4); (D) Quantitative results of cell invasion tests. Compared with model group, n=6, where *** means P <0.001 0, and ** means P <0.01.越橘提取物主要是由5种花青素(矢车菊素、飞燕草素、牵牛花色素、芍药花青素和锦葵花翠素)和分别对应3种糖苷(3-O-葡萄糖苷、半乳糖苷、阿拉伯糖苷)组合而成[4,13],已被研究证实具有多种药理活性,包括抗炎[14]、抗增殖[15]、抗血脂[16]、抗糖[17]和神经保护[18]。越橘提取物在眼部相关疾病也发挥一定的药理作用,如提高夜视能力[19]、改善糖尿病视网膜病变[4]、降眼压[20]、延缓干眼和眼疲劳[21]、预防近视[22]。值得关注的是,越橘提取物具有强大的抗氧化特性,通过诱导抗氧化酶SOD、GST或GSH-Px活性,进而降低ROS水平,最终发挥抗氧化防御机制[23]。同时,一项临床研究发现,AMD患者血清中的抗氧化酶SOD、GST或GSH-Px水平降低,伴随着体内氧化应激的增加[24]。另外,有研究发现越橘提取物能够抑制VEGF的表达和VEGF受体的激活,从而抑制血管生成[25]。这都提示越橘提取物可能参与AMD的发生与发展,但目前关于其在AMD的作用鲜有报道。
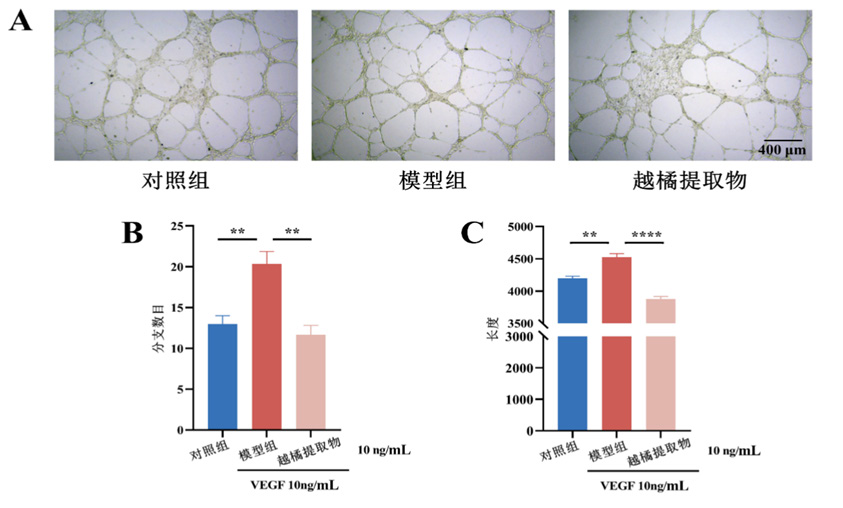
图4 越橘提取物可抑制HUVEC血管生成
Figure 4 Bilberry extract can inhibit angiogenesis in HUVEC
(A)越橘提取物对VEGF引起的血管生成的影响(x10);(B)血管生成试验分支数目定量结果;(C)血管生成试验管长定量结果。组间比较,与模型组比较,n=6,**P<0.010,****P<0.000 1。
(A) Effects of bilberry extract on VEGF-induced angiogenesis; (B) Quantitative results of branch number in the angiogenesis test(x10); (C) Quantitative results of tube length in angiogenesis test. Compared with model group n=6, where **** means P <0.000 1 and ** means P <0.01.
氧化应激是AMD形成的重要机制之一,衰老和累积的氧化压力会引发视网膜色素上皮功能障碍并最终导致不可逆损伤,保护视网膜色素上皮免受氧化损伤对于减缓AMD进展和保护视力至关重要。SIN-1在体外同时生成一氧化氮和超氧化物,被广泛用于诱导细胞氧化应激模型。本研究在SIN-1诱导细胞氧化损伤和VEGF诱导血管生成的基础上,观察越橘提取物对RPE的抗氧化以及抗血管生成作用。本研究首先进行了SIN-1浓度筛选,建立了SIN-1诱导ARPE-19细胞氧化损伤模型,发现细胞经浓度为0.25 mmol/L及以上的SIN-1处理后活力下降,确定了后续实验SIN-1浓度为0.5 mmol/L。同时,也对越橘提取物进行浓度筛选,发现浓度低于10 ng/mL的越橘提取物对ARPE-19细胞无明显毒性。然后预孵育越橘提取物干预SIN-1诱导ARPE-19细胞氧化损伤,发现细胞活力呈浓度依赖的提高。同时,越橘提取物能够降低ARPE-19细胞内ROS水平。另外,眼底新生血管生成是AMD的重要表型,而细胞迁移和侵袭对血管生成至关重要,探究越橘提取物对VEGF引起的HUVEC迁移、侵袭能力的影响,可间接反映越橘花青素对血管生成的作用。VEGF能诱导HUVEC迁移和侵袭,而给予越橘提取物处理能减少细胞迁移和侵袭。血管形成实验是体外研究血管生成的经典方法,可体外模拟血管生成状态,探究越橘提取物对血管生成的影响,可直接体现越橘提取物抑制血管生成的能力。越橘提取物还能抑制VEGF诱导细胞小管形成。这都表明越橘提取物对RPE氧化应激具有保护作用,对血管生成具有抑制作用。本研究结果提示,越橘提取物可能通过调控细胞内某些信号通路,降低ROS水平,增强RPE细胞活性,抑制血管生成,进而改善AMD。但具体作用机制还需要进行深入研究。
综上所述,越橘提取物可降低RPE细胞中ROS水平,恢复RPE细胞活力,同时抑制VEGF引起的血管生成,为其作为潜在AMD治疗药物提供了科学依据。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-nc-nd/4.0/。
基金
1. 广东省自然科学基金面上项目(2023A1515012521);广东省中医药局中医药科研项目
(20231079);广州市科技重点研发计划项目(202103000050)。
This work was supported by the Natural Science Foundation of Guangdong Province (2023A1515012521), Traditional Chinese Medicine Bureau of Guangdong Province (20231079) and Science and Technology Program of Guangzhou (202103000050), China.
This work was supported by the Natural Science Foundation of Guangdong Province (2023A1515012521), Traditional Chinese Medicine Bureau of Guangdong Province (20231079) and Science and Technology Program of Guangzhou (202103000050), China.
参考文献
1. Fleckenstein M, Keenan TDL, Guymer RH, et al. Age-related macular
degeneration[ J]. Nat Rev Dis Primers, 2021, 7(1): 31. DOI:10.1038/
s41572-021-00265-2.
2. Nashine S. Potential therapeutic candidates for age-related macular
degeneration (AMD)[ J]. Cells, 2021, 10(9): 2483. DOI: 10.3390/
cells10092483.
3. Mauray A, Milenkovic D, Besson C, et al. Atheroprotective effects of
bilberry extracts in apo E-deficient mice[ J]. J Agric Food Chem, 2009,
57(23): 11106-11111. DOI: 10.1021/jf9035468.
4. Vaneková Z, Rollinger JM. Bilberries: curative and miraculous -
A review on bioactive constituents and clinical research[ J]. Front
Pharmacol, 2022, 13: 909914. DOI: 10.3389/fphar.2022.909914.
5. Gordois A, Cutler H, Pezzullo L, et al. An estimation of the worldwide
economic and health burden of visual impairment[ J]. Glob Public
Health, 2012, 7(5): 465-481. DOI: 10.1080/17441692.2011.634815.
6. Mitchell P, Foran S. Age-Related Eye Disease Study severity scale
and simplified severity scale for age-related macular degeneration[ J].
Arch Ophthalmol, 2005, 123(11): 1598-1599. DOI: 10.1001/
archopht.123.11.1598.
7. Hanus J, Anderson C, Wang S. RPE necroptosis in response to oxidative
stress and in AMD. Ageing Res Rev, 2015, 24(Pt B): 286-298. DOI:
10.1016/j.arr.2015.09.002.
8. Tong Y, Wu Y, Ma J, et al. Comparative mechanistic study of RPE cell
death induced by different oxidative stresses[ J]. Redox Biol. 2023 Sep;
65: 102840. DOI: 10.1016/j.redox.2023.102840
9. Zhang SM, Fan B, Li YL, et al. Oxidative stress-involved mitophagy of
retinal pigment epithelium and retinal degenerative diseases[ J]. Cell
Mol Neurobiol, 2023, 43(7): 3265-3276. DOI: 10.1007/s10571-023-
01383-z.
10. Kushwah N, Bora K, Maurya M, et al.Oxidative Stress and Antioxidants
in Age-Related Macular Degeneration[ J]. Antioxidants (Basel). 2023
Jul 3; 12(7): 1379. DOI: 10.3390/antiox12071379.
11. Jensen PK. Antimycin-insensitive oxidation of succinate and reduced
nicotinamide-adenine dinucleotide in electron-transport particles. I.
pH dependency and hydrogen peroxide formation[ J]. Biochim Biophys
Acta, 1966, 122(2): 157-166. DOI: 10.1016/0926-6593(66)90057-9.
12. Pinelli R, Ferrucci M, Biagioni F, et al. Autophagy Activation Promoted
by Pulses of Light and Phytochemicals Counteracting Oxidative Stress
during Age-Related Macular Degeneration[ J]. Antioxidants (Basel).
2023 May 30; 12(6): 1183. DOI: 10.3390/antiox12061183.
13. Shi L, Li X, Fu Y, et al. Environmental Stimuli and Phytohormones in
Anthocyanin Biosynthesis: A Comprehensive Review[ J]. Int J Mol Sci.
2023 Nov 16; 24(22): 16415. DOI:10.3390/ijms242216415.
14. Roth S, Spalinger MR, Müller I, et al. Bilberry-derived anthocyanins
prevent IFN-γ-induced pro-inflammatory signalling and cytokine
secretion in human THP-1 monocytic cells[ J]. Digestion, 2014, 90(3):179-189. DOI: 10.1159/000366055.
15. Mauramo M, Onali T, Wahbi W, et al. Bilberry (Vaccinium myrtillus
L.) powder has anticarcinogenic effects on oral carcinoma in vitro
and in vivo[ J]. Antioxidants, 2021, 10(8): 1319. DOI: 10.3390/
antiox10081319.
16. Arevström L, Bergh C, Landberg R , et al. Freeze-dried bilberry
(Vaccinium myrtillus) dietary supplement improves walking distance
and lipids after myocardial infarction: an open-label randomized
clinical trial[ J]. Nutr Res, 2019, 62: 13-22. DOI: 10.1016/j.nutres.
2018.11.008.
17. Hokkanen J, Mattila S, Jaakola L, et al. Identification of phenolic
compounds from lingonberry (Vaccinium vitis-idaea L.), bilberry
(Vaccinium myr tillus L.) and hybrid bilberr y (Vaccinium x
intermedium Ruthe L.) leaves[ J]. J Agric Food Chem, 2009, 57(20):
9437-9447. DOI: 10.1021/jf9022542.
18. Borowiec K, Matysek M, Szwajgier D, et al. The influence of bilberry
fruit on memory and the expression of parvalbumin in the rat
hippocampus[ J]. Pol J Vet Sci, 2019, 22(3): 481-487. DOI: 10.24425/
pjvs.2019.129973.
19. Canter PH, Ernst E. Anthocyanosides of Vaccinium myrtillus
(bilberry) for night vision: a systematic review of placebo-controlled
trials[ J]. Surv Ophthalmol, 2004, 49(1): 38-50. DOI: 10.1016/
j.survophthal.2003.10.006.
20. Steigerwalt RD Jr, Belcaro G, Morazzoni P, et al. Mirtogenol potentiates
latanoprost in lowering intraocular pressure and improves ocular blood
flow in asymptomatic subjects[ J]. Clin Ophthalmol, 2010, 4: 471-476.
DOI: 10.2147/opth.s9899.
21. Kosehira M, Machida N, Kitaichi N. A 12-week-long intake of bilberry
extract (Vaccinium myrtillus L.) improved objective findings of ciliary
muscle contraction of the eye: a randomized, double-blind, placebocontrolled, parallel-group comparison trial[ J]. Nutrients, 2020, 12(3):
600. DOI: 10.3390/nu12030600.
22. Kamiya K, Kobashi H, Fujiwara K, et al. Effect of fermented bilberry
extracts on visual outcomes in eyes with myopia: a prospective,
randomized, placebo-controlled study[ J]. J Ocul Pharmacol Ther,
2013, 29(3): 356-359. DOI: 10.1089/jop.2012.0098.
23. Juadjur A, Mohn C, Schantz M, et al. Fractionation of an anthocyaninrich bilberry extract and in vitro antioxidative activity testing[ J]. Food
Chem, 2015, 167: 418-424. DOI: 10.1016/j.foodchem.2014.07.004.
24. Mitchell P, Liew G, Gopinath B, et al. Age-related macular degeneration
[ J]. Lancet, 2018, 392(10153): 1147-1159. DOI: 10.1016/S0140-
6736(18)31550-2.
25. Matsunaga N, Chikaraishi Y, Shimazawa M, et al. Vaccinium myrtillus
(bilberry) extracts reduce angiogenesis in vitro and in vivo[ J]. Evid
Based Complement Alternat Med, 2010, 7(1): 47-56. DOI: 10.1093/
ecam/nem151.