TGF-β1 短期眼部应用对兔眼角膜碱烧伤后整合素 β1 表达的作用
阅读量:2492
发布日期:2024-10-17
作者:
王峰 ,孙烨 ,卢媛媛 ,马为梅
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
转化生长因子- β1
角膜碱烧伤
整合素 β1
摘要
目的: 研究 TGF-β1 短期眼部应用对兔角膜碱烧伤后整合素 β1 表达和角膜上皮愈合的影响,探求其对角膜碱烧伤的治疗作用。
方法: 制备大耳白家兔角膜碱烧伤模型, 一组给予 TGF-β1 (浓度为 200 ng /ml) 局部滴眼, 每日 3 次, 连续 7 日; 另一组给予 PBS 溶液代替, 处理相同。于角膜碱烧伤后每日观察角膜上皮愈合面积, 并于烧伤后 6 h、1 d、3 d、7 d 和 14 d 5 个时间点应用免疫组化方法检测 TGF-β1 实验组与 PBS 组角膜整合素 β1 表达情况。
结果: 烧伤后 4 d、10 d、11 d、12 d 和 14 d 实验组和对照组上皮愈合率比较, 差异有统计学意义(P < 0.05) , 两组随着上皮修复过程的进行, 整合素 β1 的表达均逐渐增加, 烧伤后 7 d、14 d两个时间点实验组和对照组整合素 β1 平均灰度值比较, 差异有显著性(P < 0.05) 。
结论: TGF-β1 在活体实验中能促进整合素 β1 的表达, 而后者的增加可以促进角膜上皮细胞向损伤区域的移行和粘附, 从而减少碱烧伤愈合过程中上皮再次脱落现象, 有利于创伤愈合。
全文
角膜碱烧伤是一种常见的致盲性眼病, 角膜上皮再生不良或延迟愈合会导致修复过程异常迟缓, 并发症多而严重。整合素超家族作为细胞粘附分子之一, 介导细胞与细胞、细胞与基质的粘附, 在角膜上皮损伤愈合中起很重要的作用[1]。转化 生 长 因 子 β1 (Transforming growth factor beta1, TGF-β1) 是调节细胞增殖、分化和细胞间质蛋白表达的一类多功能的细胞生长因子[2]。已有研究[3, 4]表明, TGF-β1 在体外细胞培养实验中可以上调整合素 β1 及其配体纤维连结蛋白的表达, 但对于活体角膜损伤动物模型中外源性 TGF- β1 对于角膜上皮愈合的影响, 报道不多。本实验旨探讨 TGF-β1 对整合素 β1 表达的影响及其在角膜碱烧伤中的作用机制。
材料与方法
一、实验试剂
重组人 TGF-β1 购自 PEPROTECH 公司, 5 μ g加 入 灭 菌 的 0.01 mol/L, pH7.4 磷 酸 盐 缓 冲 液(PBS) , 配制成浓度为 200 ng/ml TGF-β1-PBS 溶液, 分装, - 20℃冰箱中保存备用。抗兔整合素 β1(integrin β1) 多克隆抗体购自武汉博士德公司, 即用型 SABC 试剂盒和 DAB 酶底物显色试剂盒购自北京中杉金桥生物技术有限公司。
二、实验动物
健康成年大耳白家兔 33 只, 由西安交通大学医学院实验动物中心提供, 雌雄不限, 体重 2.0 ~2.5 kg , 裂隙灯显微镜检查无眼前节疾病。
三、角膜碱烧伤模型制备
0.1%丁卡因表面麻醉, 取直径为 8 mm 的单层圆形滤纸片浸入 1 mol/L NaOH 溶液中饱和后取出,置于角膜中央 40 s 后移去, 60 ml 生理盐水连续冲洗眼表面和结膜囊, 得到中度角膜碱烧伤模型。
四、实验分组及处理
33 只家兔中随机选取 3 只为正常对照, 其余30 只制备双眼碱烧伤模型, 按随机数字表法分为实验组和对照组, 各 15 只。自烧伤当日起至烧伤后第 7 日止, 实验组用 TGF-β1-PBS 溶液, 对照组用 0.01 mol/L PBS 溶液, 滴眼, 每日 3 次 , 每 次 2滴。烧伤模型兔眼均用 0.25%氯霉素滴眼液点眼,自造模之日起至观察结束, 每日 3 次。


五、活体观察
伤后 12 h、第 1 天至第 14 天, 每天裂隙灯显微镜检查, 荧光素染色观察角膜上皮缺损及荧光素着色面积并照相, 照片经计算机图像分析系统处理, 用以下公式[5] 计算角膜上皮愈合率:

六、形态学和免疫组化观察
实验组和对照组均于造模后 6 h、1 d、3 d、7 d和 14 d 5 个时间点分别处死 3 只实验动物。摘取眼球沿角膜缘后1 mm 处环行剪下完整角膜 ,10%甲醛溶液固定, 常规石蜡包埋, 连续切片, 每片厚 5 μ m, 取相邻切片进行苏木素- 伊红(HE) 染色形态学观察, 并使用德国 LEICA 公司 Q550CW型图像信号采集与分析系统对角膜组织 HE 染色切片进行分析处理, 在高倍视野(400×) 下连续取5 个视野, 利用系统中自带的标尺, 测量单个空泡面积大小及每个高倍视野下全部空泡面积的总和, 以其均值作为该标本的空泡总面积, 以相同方法测量同一时间点同一组别的其余标本的空泡总面积。采用链酶亲和素- 过氧化物酶法(SABC 法)检测兔角膜整合素 β1 的表达情况, 另用 PBS 代替一抗为阴性对照。判断标准: 整合素 β1 为棕黄色颗粒, 胞膜着色, Motic Med 6.0 数码医学图像分析系统(A) 进行半定量分析, 检测角膜上皮阳性区域的平均灰度值。
七、统计学方法
采用 SPSS13.0 统计软件进行统计学分析, 所有实验数据采用 X̄±s 表示, 组间差异采用两独立样本t 检验, 组内不同时间点差异采用单因素方差分析, LSD-t 检验。
结果
一、角膜上皮愈合情况
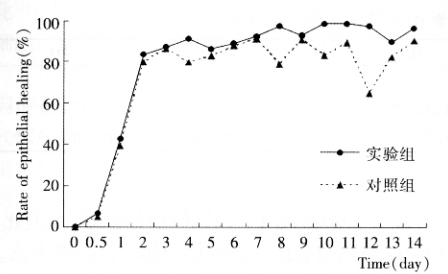
角膜上皮愈合率变化曲线(图 1) 提示: 兔角膜碱烧伤后 12 h 内角膜上皮修复缓慢, 此后到 2d 为高峰愈合期, 呈直线上升, 两组间平均愈合率无明显差异 , 至 2 d 时 两 组 上 皮 愈 合 均 达 到 约80%。碱烧伤后 3 d 至 14 d 愈合相对缓慢, 并出现波动, 即: 荧光素着色区的扩大及上皮的再次脱落。对照组于烧伤后 4 d、8 d、10 d、12 d 表现出明显的 4 次波动, 幅度较大, 最小的波动为 6.77%, 最大的为 12 d, 与 11 d 相比减少 32.37%, 单因素方差分析组内比较P = 0.035, 差异有显著性。实验组于烧伤后 5 d、9 d、13 d 也出现 3 次波动, 愈合率变动均小于 6%, 单因素方差分析组内比较, 差异无统计学意义。实验组和对照组组间相同时间愈合率比较,烧伤后 4 d、10 d、11 d、12 d 和 14 d 实验组和对照组上皮愈合率差异有统计学意义(P <0.05) 。
图 1 角膜上皮愈合率变化曲线
二、碱烧伤后角膜 HE 染色病理学观察
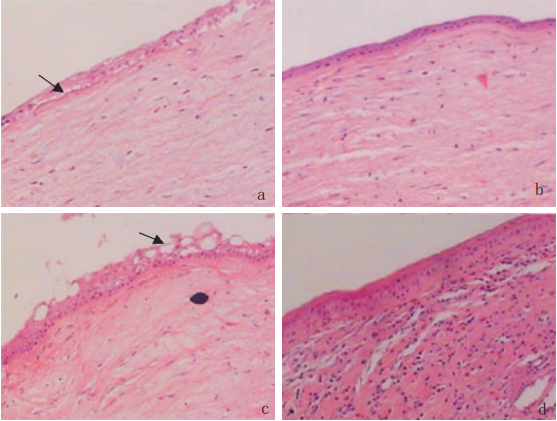
烧伤后 6 h, 烧伤边缘残存上皮细胞变扁平,呈单层向烧伤区移行。烧伤后 1 d, 近烧伤边缘区已有约 1 / 4 烧伤区为单层扁平上皮细胞覆盖, 烧伤区周围角膜基质水肿, 有中性粒细胞及巨噬细胞浸润。在烧伤后 6 h 和 1 d, 两组 HE 表现基本相同。至烧伤后 3 d, 实验组约有 1 / 2 烧伤区为新生上皮覆盖, 近边缘新生上皮层数增加到 2~3 层, 近烧伤区中央新生上皮仍为单层, 角膜缘基质层中可见大量炎性细胞浸润, 基质增厚; 而对照组新生上皮覆盖区<1 / 2 烧伤区, 单层新生上皮间连接较实验组疏松。烧伤后 7 d, 两组角膜上皮细胞基本覆盖烧伤区, 近边缘区新生上皮由表层的 2 ~3 层扁平细胞和下层的单层立方细胞组成, 烧伤区中心上皮细胞为 2 ~3 层扁平细胞, 但对照组新生上皮层与下方基质间有较多空泡, 连接似不够紧密, 上皮下基质水肿、结构疏松, 炎性细胞浸润明显。烧伤后 14 d, 实验组与对照组角膜上皮缺损均已修复,新生上皮为 4 ~5 层, 由 1 ~2 层立方上皮细胞和 2~3 扁平细胞组成, 与实验组相比, 对照组新生上皮细胞浅层中可见大小不等较多空泡状结构, 使部分区域的表层扁平细胞和基底层立方上皮细胞分离,而实验组基质中可见成群聚集的中性粒细胞及大量成纤维细胞, 烧伤区基质增厚明显(图 2) 。
上皮空泡总面积结果为: 烧伤后 7 d 空泡总面积均值对照组为 19827.97 μ m2 , 最大单个空泡面积达 6142.26 μ m2 ; 实验组为 10910.38 μ m2 , 最大单个空泡面积为 1157.73 μ m2 。烧伤后 14 d 空泡总面积均值对照组为 61633.55 μ m2 , 最大单个空泡面积为 11332.10 μ m2 ; 实验组为38878.54 μ m2 ,最大单个空泡面积为 9155.79 μ m2 。不同时间点实验组与对照组空泡总面积经两独立样本t 检验,均显示有统计学差异(P < 0.01) 。
三、整合素 β1 免疫组化结果
整合素 β1 在正常兔角膜上皮基底细胞膜侧基底面有微弱表达,碱烧伤后角膜上皮全层细胞胞膜均有表达, 以基底细胞膜基底面和侧面为著,呈弧形或环行染色。表 1 为不同时间点各组角膜上皮整合素 β1 平均灰度值。由表 1 可得: 碱烧伤后实验组和对照组组内不同时间点角膜上皮整合素β1 平均灰度值, 经单因素方差分析检验, P < 0.05,差异有显著性, 即两组随着上皮的修复, 整合素 β1的表达均逐渐增加。碱烧伤后 1 d、3 d、7 d 和 14 d实验组、对照组角膜上皮整合素 β1 平均灰度值与正常组相比, P < 0.05, 差异有显著性。碱烧伤后不同时间点实验组和对照组间 t 检验可得: 烧伤后 7 d 和 14 d 两个时间点实验组和对照组整合素 β1 平均灰度值比较, P < 0.05, 差异有显著性, 6 h、1 d 和3 d 虽两组间灰度值有差别, 但 P >0.05, 无显著性。
讨论
TGF-β1 是调节细胞增殖、分化和细胞间质蛋白表达的一类多功能的细胞生长因子, 在人角膜上皮细胞、基质成纤维细胞和内皮细胞中都有表达。Louise 等证实 TGF-β1 对培养的角膜缘和角膜周边部的上皮克隆形成和克隆增殖有显著剂量相关性的负相调节作用, TGF-β1 推迟再上皮化, 增加基质再生, 促角膜细胞增殖和肌成纤维细胞分化[6] 。Imanishi 也证实 TGF-β1 和 TGF-β2 都抑制角膜上皮细胞的增殖, TGF-β2 抑 制 作 用 更 强[7] ,且使用抗- TGF-β1 单克隆抗体可以促进鼠穿透性角膜损伤后的上皮细胞增殖[8] 。但同时也有研究表 明 细 胞 移 行 覆 盖 角 膜 创 口 时 TGF-β受 体 1&2均高水平表达, 培养的角膜上皮细胞中加入 TGF-β1 明显增加细胞周期抑制物 p15 的表达, 使细胞退出细胞周期参与移行, 而有利于上皮愈合[9]。TGF-β1 基因敲除的小鼠, 伤后 10 d 出现薄而少血管的肉芽组织, 并且有显著的炎症细胞浸润, 后续出现再上皮化的减少和胶原沉积的减少, 而不利于伤口愈合[10] , 而内源性 TGF-β可以促进鼠损伤愈合期上皮细胞的移行, 同时抑制移行细胞增殖,这有赖于 p38MAPK 信号转导途径完成[8] 。因此,TGF-β1对角膜创伤上皮的愈合作用尚存在争议。

图 2 碱烧伤后 7 d 和 14 d 对照组与实验组病理形态学改变
( a) 烧伤后 7 d 对照组新生上皮为 2 ~3 层扁平细胞平行排列, 新生上皮与基质层间可见空泡( 箭头所示) ;(b) 烧伤后 7 d 实验组新生上皮细胞间, 上皮与基质间均连接紧密;(c) 烧伤后 14 d 对照组新生上皮中表层扁平细胞和底层立方细胞间存在空泡( 箭头所示) , 排列紊乱, 结构松散; (d) 烧伤后 14 d 实验组新生上皮复层细胞排列规则、紧密HE×100
表 1 不 同 时 间 点 各 组 角 膜 上 皮 整 合 素 β1 平 均 灰 度 值( x±s, n =6)

整合素是广泛表达跨膜粘附受体, 由非共价键连接的 αβ亚基构成的异二聚体, 介导细胞与细胞, 细胞与细胞外基质的相互作用, 参与胚胎发育、创伤愈合、肿瘤转移多种病理生理过程。整合素 β1 家族作为最大的一类, 在眼表分布广泛, 与多种细胞外基质相互作用, 参与细胞分化、移行和粘附[1] , 其中整合素 α5β1 是 FN 的经典受体, 国外有文献报道整合素 α4β1 也可作为 FN 受体, 参与细胞与细胞基质间的相互作用[11] 。研究表明: 上皮细胞的移行是角膜伤口愈合的起始环节, FN- 整合素系统在此过程中发挥重要的作用。上皮细胞通过与作为暂时性基质的 FN 的粘附- 解离- 粘附过程, 逐渐向 缺损区移行覆盖, 以实现上皮的愈合[12] 。TGF-β1 为整合素的促进因子之一, 已有实验[3, 4] 证实 TGF-β1 在体外细胞培养实验中可以上调整合素 β1 及其配体纤维连结蛋白的表达。
本实验中观察到, 在兔正常角膜整合素 β1 仅在基底上皮细胞的基底侧细胞膜少量表达, 碱烧伤后 6 h, 邻近上皮细胞即已开始表达增加, 说明在创伤愈合早期, 整合素就已参与了损伤的修复;而且随上皮修复过程的进展, 整合素 β1 的表达进行性增加, 以利于新生上皮细胞的迁移、上皮与其下基质的粘附, 均与文献报道一致。
本实验中也观察到, 在角膜碱烧伤愈合的整个过程中, 外源性 TGF-β1 的使用对角膜上皮愈合并无明显抑制, 反而在愈合中期(7 d~14 d) 减少了上皮的再次脱落而利于上皮愈合。这与部分文献报道有出入, 原因可能为与体外细胞培养或器官培养模型不同, 活体角膜碱烧伤模型中, 机体的炎症反应和损伤修复机制的启动, 内源性细胞因子的大量分泌, 使 TGF-β1 抑制上皮细胞增殖的作用不再成为主导因素, 而其促进上皮细胞移行的作用凸现出来。角膜上皮损伤早期主要是损伤周围上皮移行覆盖创面, 后期角膜缘干细胞增殖促进再生上皮复层化[13] , 本实验中外源性 TGF-β1 的短期使用, 对后期细胞增殖的抑制作用较弱, 可能也是原因之一。
在对照组烧伤后 7 d 和 14 d 时, HE 染色观察到新生的复层上皮细胞间、细胞与基质间中出现较多空泡、局部连接疏松, 而外源性 TGF-β1 实验组相同时间点 HE 染色观察新生的复层上皮细胞间、细胞与基质间中空泡较少、细胞排列较整齐,连接相对紧密, 同一时间点实验组空泡总面积明显小于对照组; 而同时, 实验组角膜上皮整合素β1 的表达在烧伤后 7 d 和 14 d 明显高于对照组。这说明新生的角膜上皮细胞要形成良好的复层结构, 与上皮下基质牢固粘附而避免再次脱落及上皮细胞整合素 β1 的表达成正相关。同时实验组的结果也表明外源性 TGF-β1 的短期使用可以增加新生上皮细胞整合素 β1 的表达, 提高角膜上皮的粘附能力, 促进角膜上皮愈合, 与体外实验研究结果相符。而 TGF-β1 增加上皮细胞整合素 β1 的表达的机制目前尚不清楚, 可能与二者存在共同的细胞信号转导途径, 如 p38MAPK 途径[14] , 通过丝苏氨酸蛋白激酶活性的改变影响被调控基因的转录活性使整合素 β1 基因的表达增强有关。至于外源性 TGF-β1 滴眼液是否真正能够应用于角膜碱烧伤的治疗, 治疗时机的选择, 用药浓度和时间长短的确定, 还需要很多后续实验的支持。
基金
暂无基金信息
参考文献
1. Vigneault F, Zaniolo K, Gaudreault M, et al. Control of integrin genes expression in the eye. Prog Retin Eye Res, 2007; 26( 2) : 99- 161.
2. Cordeiro M F. Beyond mitomycin: TGF-[ beta] and wound healing. Prog Retin Eye Res, 2002; 21( 1) : 75- 89.
3. 吴浩, 张月娥, 许祖德, 等. 实验性肺纤维化大鼠肺组织整合素 α_5β_1 和转化生长因子- β的表达. 中华病理学杂志, 1999; 28( 6) : 427- 431.
4. 周晓虹, 张月娥, 张秀荣, 等. β_1 型 转 化 生 长 因 子对大鼠肝 Ito 细胞整合素 α_5、β_1 表达的调节. 中华医学杂志, 1997; 77( 7) : 539- 540.
5. 刘琳, 李永平, 黄树其, 等. 角质细胞生长因子 2 促进兔角膜碱烧伤上皮愈合机制的研究. 中华眼科杂志,2005; 41( 4) : 364- 368.
6. Carrington L M, Albon J, Anderson I, et al. Differential Regulation of Key Stages in Early Corneal Wound Healing by TGF-{beta} Isoforms and Their Inhibitors. Invest Ophth Vis Sci, 2006; 47( 5) : 1886- 1894.
7. Imanishi J, Kamiyama K, Iguchi I, et al. Growth factors: importance in wound healing and maintenance of transparency of the cornea. Prog Retin Eye Res, 2000; 19 ( 1) : 113- 129.
8. Saika S, Okada Y, Miyamoto T, et al. Role of p38 MAP Kinase in Regulation of Cell Migration and Proliferation in Healing Corneal Epithelium. Invest Ophth Vis Sci, 2004; 45( 1) : 100- 109.
9. Zieske J D, Hutcheon A E, Guo X, et al. TGF-{beta} Receptor Types I and II Are Differentially Expressed during Corneal Epithelial Wound Repair. Invest Ophth Vis Sci, 2001; 42( 7) : 1465- 1471.
10. Brown R L, Ormsby I, Doetschman T C, et al. Wound healing in the transforming growth factor-beta-deficient mouse. Wound Repair Regen, 1995; 3( 1) : 25- 36.
11. Wu C, Fields A J, Kapteijn B A, et al. The role ofalpha 4 beta 1 integrin in cell motility and fibronectin matrix assembly. J Cell Sci, 1995; 108( 2) : 821- 829.
12. Suzuki K, Saito J, Yanai R, et al. Cell-matrix and cellcell interactions during corneal epithelial wound healing. Prog Retin Eye Res, 2003; 22( 2) : 113- 133.
13. Lu L, Reinach P S, Kao W W, et al. Corneal Epithelial Wound Healing. Exp Biol Med, 2001; 226( 7) : 653- 664.
14. Bhowmick N A, Zent R, Ghiassi M, et al. Integrin beta 1 Signaling Is Necessary for Transforming Growth Factorbeta Activation of p38MAPK and Epithelial Plasticity. J
Biol Chem, 2001; 276( 50) : 46707- 46713.