缺氧诱导因子-1信号通路在高眼压模型中的表达
阅读量:3199
DOI: doi: 10.3978/ j.issn.1000-4432.2017.07.03
发布日期:2024-12-10
作者:
吴克玲 ,龚若文 ,董旭 ,左成果 ,高新博 ,林明楷
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
高眼压
视网膜神经节细胞
缺氧诱导因子-1
血管内皮生长因子-A
促红细胞生成素
摘要
目的:研究缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号通路在高眼压状态下的表达情况。方法:利用前房注射磁性微球法建立大鼠高眼压动物模型,通过荧光金逆行标记观察视网膜神经节细胞(retinal ganglion cells,RGCs)的存活情况,提取视网膜组织行Western印迹检测HIF-1α、血管内皮生长因子-A(vascular endothelial growth factor A,VEGF-A)-和促红细胞生成素
(erythropoietin,EPO)的表达,并分析HIF-1α的变化趋势与眼压之间的关系。结果:高眼压1 d时平均眼压为(40.33±2.94) mmHg,第3天为(68.83±2.85) mmHg,第10天时下降至(43.67±3.67) mmHg,后趋于稳定,与对照眼相比差异均有统计学意义(P<0.01)。高眼压2周时中央、中间和周边视网膜的RGCs存活率分别为61.1%±1.1%,68.5%±8.5%和73.6±3.6%,至高眼压3周迅速下降,分别为33.2%±3.2%,43.4%±3.4%和51.4%±2.1%。高眼压3 d时,眼压值达最高,HIF-1α,VEGF-A和EPO的表达亦达高峰,与对照组相比差异均有统计学意义(P<0.01);后随着眼压值下降,表达也随之逐渐减少。眼压升高3 d,7 d,2周分别与对照组的HIF-1α/GAPDH的蛋白灰度比和眼压值间的相关系数为0.977,0.886,0.763,差异具有统计学意义(P<0.01)。结论:HIF-1α的表达在一定条件下与眼压值呈正相关,该通路的早期激活可能在高眼压病程中扮演重要的角色。
全文
血管缺血学说是青光眼的重要发病机制之一,近年来随着Angio-OCT的广泛研究与应用,对青光眼眼部血流状态有了更多的认识。青光眼视网膜神经节细胞(retinal ganglion cells,RGCs)的死
亡过程是一个缓慢的凋亡过程,具体可分为两个阶段:第一阶段是缺血、缺氧造成的细胞损害;第二阶段是受损的退变细胞释放有害物质引起基质的改变和损伤。细胞缺氧能够诱导谷氨酸兴奋
性毒性的发生,进而损害神经节细胞[1]。
缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)作为目前唯一对氧最为敏感、对组织缺氧和其他刺激反应最早的调节因子[2],能够通过激活下游基因的表达, 增强一系列适应性反应,如血管生成、血红素生成、能量代谢和细胞增殖等[3],使细胞适应于短暂且温和的缺氧环境。Savagian等[4] 通过免疫荧光组织化学方法发现青光眼动物模型视网膜的HIF-1α表达增强,Tezel等[5] 也发现青光眼患者视网膜和视神经HIF-1α的表达增加,均从另一角度证实青光眼存在缺血状态。既往研究[6-7]通过反复的缺氧预刺激,发现不管在急性或慢性高眼压模型中,早期RGCs的胞体和轴 突损伤均明显减轻,同时研究[8]表明该刺激能够在疾病的早期阶段通过激活缺氧相关因子来保护RGCs的形态和功能。HIF-1是缺氧相关因子之一,而这种神经保护作用的实现很可能与其通路的激活有关[9-10]。然而,截至目前,在高眼压状态下HIF-1信号通路的表达趋势和作用机制尚不十分明确,本研究旨在探索该通路在高眼压状态下的表达情况及可能起到的作用。
缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)作为目前唯一对氧最为敏感、对组织缺氧和其他刺激反应最早的调节因子[2],能够通过激活下游基因的表达, 增强一系列适应性反应,如血管生成、血红素生成、能量代谢和细胞增殖等[3],使细胞适应于短暂且温和的缺氧环境。Savagian等[4] 通过免疫荧光组织化学方法发现青光眼动物模型视网膜的HIF-1α表达增强,Tezel等[5] 也发现青光眼患者视网膜和视神经HIF-1α的表达增加,均从另一角度证实青光眼存在缺血状态。既往研究[6-7]通过反复的缺氧预刺激,发现不管在急性或慢性高眼压模型中,早期RGCs的胞体和轴 突损伤均明显减轻,同时研究[8]表明该刺激能够在疾病的早期阶段通过激活缺氧相关因子来保护RGCs的形态和功能。HIF-1是缺氧相关因子之一,而这种神经保护作用的实现很可能与其通路的激活有关[9-10]。然而,截至目前,在高眼压状态下HIF-1信号通路的表达趋势和作用机制尚不十分明确,本研究旨在探索该通路在高眼压状态下的表达情况及可能起到的作用。
1 材料与方法
1.1 实验动物
BN(Brown Norway)大鼠(6~8周雄性)由北京维通利华公司提供,均排除眼部及全身疾病。随机分为5组,每组10只,共50只,分别为对照组、高眼压3 d组、高眼压7 d组、高眼压2周组和高眼压3周组。所有动物均对右眼进行操作,左眼不做处理。动物饲养于中山大学中山眼科中心SPF级动物实验室,本研究所采用的各种动物实验操作均经动物管理委员会批准。
1.2 高眼压模型的建立
10%水合氯醛(中山大学中山眼科中心)腹腔注射行全身麻醉,爱尔凯因(Alcon)行手术眼局部麻醉后,将直径约6 mm的环形磁铁固定在眼球周围;用显微针头(Hamilton)行前房穿刺,33g显微注射器(Hamilton)从穿刺口进入,往前房注入含8 μm磁性微球(Bangs Laboratories)的生理盐水溶液(体积25 μL,浓度50 mg/mL),注射后停针1 min,缓慢拔出针头。注射时避开虹膜和晶体,并注意保护角膜。眼前节观察,磁性微球均匀分布在房角周围的予以纳入,若微球沉着于中央角膜及晶状体,则予以排除。术毕涂妥布霉素眼膏。对照组右眼行前房穿刺,并注入等量生理盐水,以最大限度接近实验组操作。
1.3 眼压测量
建模前、建模后每隔3~4 d行眼压测量并记录,时间均为上午8:00–9:00。将针头的金属端插入Tono-lab测量头,垂直角膜中央,利用回弹式原理行眼压测量;测量中保证动作轻柔及使大鼠处于安静状态。取连续6个误差小于5%的读数进行记录,连续6个读数的平均值为该日平均眼压。造模
后开始眼压低于假手术组的1.5倍予以排除。
1.4 RGCs 荧光金逆行标记
将已麻醉的大鼠置于三维立体定位仪(深圳市瑞沃德生命科技有限公司)上,剪除上丘处毛发,行皮肤碘伏消毒后纵行切开皮肤及皮下组织,暴露颅骨。于冠状缝后6.0 mm,矢状缝两侧旁开3.0 mm处做标记。标记后用电钻(STRONG
90)于颅骨钻孔,直径约0.5 mm。显微注射器吸取4%荧光金(FluoroChrome)3 μL,垂直固定于颅骨表
面,缓慢进针,深度为4 mm,将荧光金缓慢注入上丘,停针1分钟后拔出,对侧眼注射采用相同方法;对位缝合皮肤及皮下组织,涂擦典必殊眼膏(Alcon);所有大鼠均于取材前1周行荧光金注射。
1.5 视网膜铺片
大鼠10%水合氯醛过量麻醉后,剪断视神经,摘除眼球。4%多聚甲醛固定60 min,待球壁坚硬时,取出眼球,于角膜缘后1 mm处行全周剪开,
移去眼前节,清除玻璃体;将视网膜与脉络膜分离,把视网膜置于载玻片,玻璃体腔面向上,完整展开,以视神经为中心做4个放射状切口,使其呈花瓣状。滴抗荧光淬灭剂(北京普利莱),封片,行图像采集。
1.6 Western印迹
将视网膜置于裂解液(碧云天生物科技有限公
司)中,行超声粉碎,离心,取上清,BCA法测蛋白浓度;分别配制8%和10%胶;将5;上样缓冲液
和样品按1:4比例混匀,煮沸5 min后冷却。把标志物和蛋白质样品加入电泳道,恒压90 V电泳。在冰水混合物上,250 mA电转2 h。转膜完毕,将PVDF膜置于TBST液摇床上摇洗,5%脱脂牛奶室温封闭1
h。按不同浓度要求孵育一抗,HIF-1α(美国Novus
Biologicals公司,1:250)、VEGF-A(美国Abcam公
司,1:500)、EPO(美国Abcam公司,1:500),4 ℃
过夜。TBST液摇床上摇洗后孵育二抗,鼠抗(美国CST公司,1:3 000),兔抗(CST,1:3 000),室温1
h。再进行TBST液摇床上摇洗,暗室内ECL试剂盒曝光。ImageJ行蛋白灰度定量分析。
1.7 统计学处理
SPSS20.0统计学软件进行数据处理。统计结果以均数±标准差(x±s)表示,方差分析法比较组间差异,进一步采用Bonferroni法行两两比较。Pearson法行相关性分析。所有实验数据统计结果
中,P<0.05为差异有统计学意义。
2 结果
2.1 高眼压模型眼前段照相
眼前段照相可观察到微球位于大鼠眼球角巩缘,位置较固定,晶体表面无沉着,视轴未受阻挡。HE染色可见微球完全阻塞于小梁网,模拟了青光眼小梁网阻塞的机制(图1)。
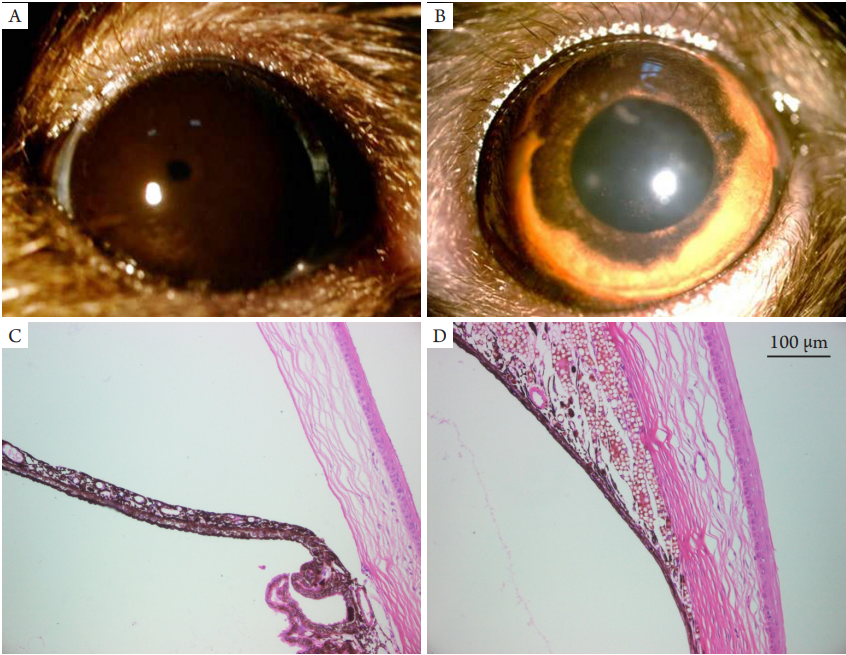

图1 高眼压动物模型造模前、后眼前段
Figure 1 Anterior ocular segment before and after injection
(A)造模前和(B)造模后行眼前段照相情况(×16);(C)造模前和(D)造模后房角HE染色情况(×200)。
Anterior segment radiography before (A) and affer (B) injection respectively (×16); HE staining of anterior chamber angle before (C) and
affer (D) injection respectively (×200).
2.2 高眼压模型眼压测量
眼压升高1天时平均眼压为(40.33±2.94) mmHg
(1 mmHg=0.133 kPa) ,第3 天时眼压达峰值(68.83±2.85) mmHg。第10天时,眼压逐渐下降至(43.67±2.94) mmHg,后趋于稳定。从第1天开始,各测量时间的高眼压组眼压值与对照组相比均明显增高,差异均有统计学意义(P<0.01),且都维持在对照组的1.5倍以上。该方法成功引起眼压升高,且较为稳定,可维持2~4周(图2,表1)。
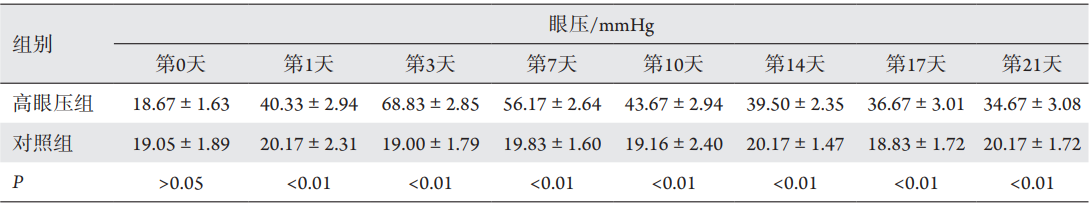
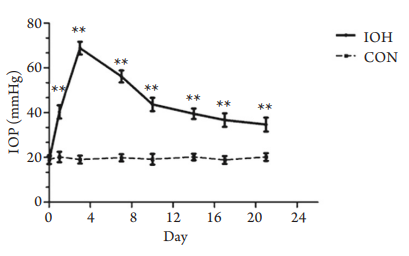
表1 建模前和建模后各测量时间对照组和高眼压组眼压测量值(x±s)
Table 1 IOP measurement between the intraocular hypertension (IOP) and the control group at different time points before and
after injection (x±s)


图2 高眼压组和对照组各时间点眼压值曲线图
Figure 2 Comparison of IOP curves between the IOH and
control groups
与对照组相比,**P<0.01。
Compared with the control group, **P<0.01.
2.3 高眼压模型RGCs逐渐减少
高眼压2周组与对照组相比,不管是中央、中间,还是周边视网膜,均出现明显的RGCs凋亡,RGCs的存活率分别为61.1%±1.1%,68.5%±8.5%,73.6%±3.6%,差异具有显著统计学意义(P<0.01)。高眼压3周时,RGCs的存活率明显下降,分别为33.2%±3.2%,43.4%±3.4%,51.4%±1.4%,与对照组相比,差异同样具有统计学意义(P<0.01)。对比2周及3周组,可以观察到RGCs的存活率的显著性下降,差异有统计学意义(P<0.01,图3,4)。
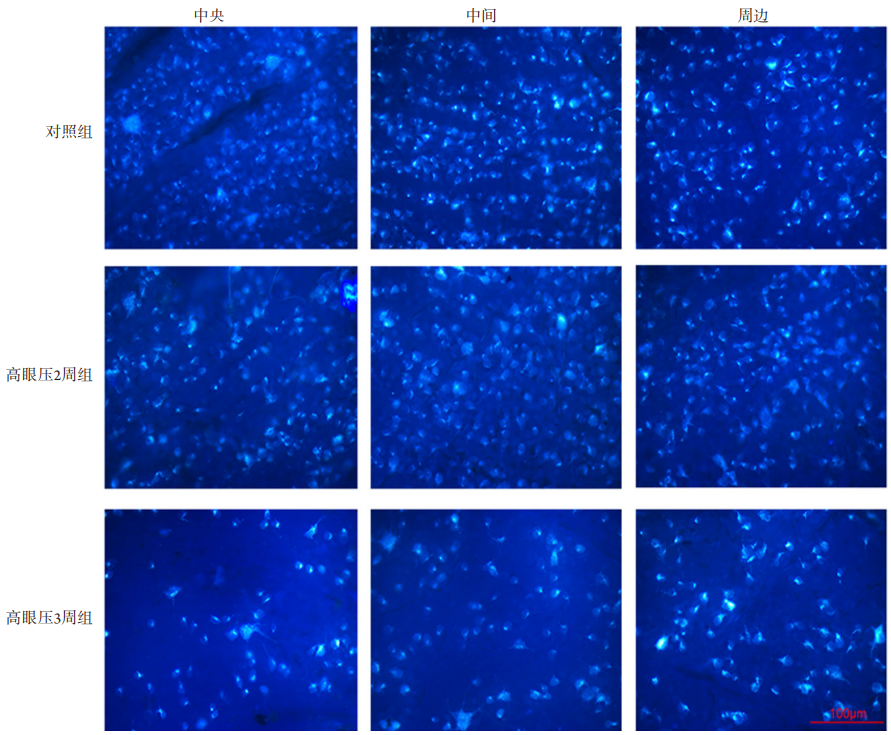
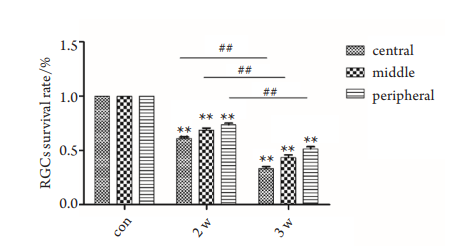

图3 高眼压模型及对照组视网膜RGCs荧光金逆行标记图(×400)
Figure 3 RGCs retrograde labelling of retina between the IOH and control groups (×400)

图4 高眼压模型和对照组视网膜RGCs荧光金逆行标记统计图
Figure 4 Bar chart of RGCs retrograde labelling of retina between
the IOH and control groups
与对照组比较,**P<0.01;高眼压组间两两比较,##
P<0.01。
Compared with the control group, **P<0.01; the multiple
comparisons among the IOH groups,
##
P<0.01.
2.4 高眼压模型 HIF-1α表达增多
对照组可检测到极微量的HIF-1α;高眼压3天组与对照组相比,HIF-1α蛋白的表达差异具有统计学意义(P<0.01),说明视网膜组织在眼压处于较高水平时,开始出现大量HIF-1α积聚;高眼
压7天组与对照组相比,差异也具有统计学意义(P<0.01),在高眼压的前1周,眼压都维持在较高水平,HIF-1α蛋白量也较多;但是,对照组分别与高眼压2周组和3周组比较,差异均无统计学意
义(P>0.01),同时高眼压3天组和高眼压7天组分别与高眼压2周组和3周组比较,差异具有统计学意义(P<0.01,图5)。
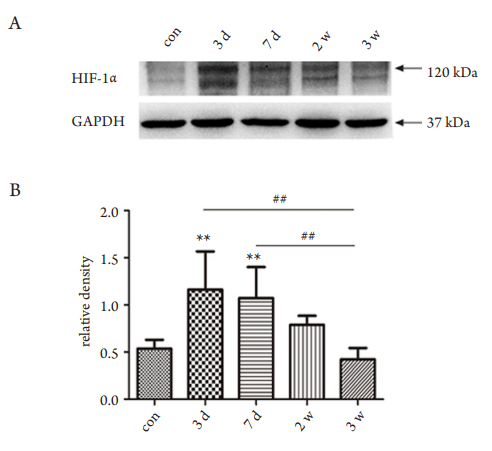

图5 高眼压模型和对照组视网膜组织HIF-1α的蛋白表达
Figure 5 Expression of retinal HIF-1αprotein between the IOH and
control groups
以GAPDH为内参,对灰度值进行统计分析。(A)Western印
迹电泳条带图;(B)相应条带灰度分析图。与对照组比较,**P<0.01;与对照组比较,**P<0.01;高眼压组间两两比
较,## P<0.01。The GAPDH was taken as internal control and the grey value was
analyzed. (A) Band of Western blot; (B) analysis of the grey value
of relevant band. Compared with the control group, **P<0.01; the
multiple comparisons among the IOH groups,
## P<0.01.
2.5 HIF-11 蛋白表达与眼压的相关性分析
将高眼压3天组、高眼压7天组、高眼压2周组、高眼压3周组分别和对照组所对应的HIF-1α/
GAPDH的蛋白灰度比与眼压值进行相关性分析,发现前3者和对照组之间存在显著的正相关关系,相关系数分别为0.977,0.886,0.763,差异具有统计学意义(P<0.01),呈现逐渐下降的趋势;而高眼压3周组和对照组间的相关系数为−0.522,差异不具有统计学意义(P>0.05,图6)。
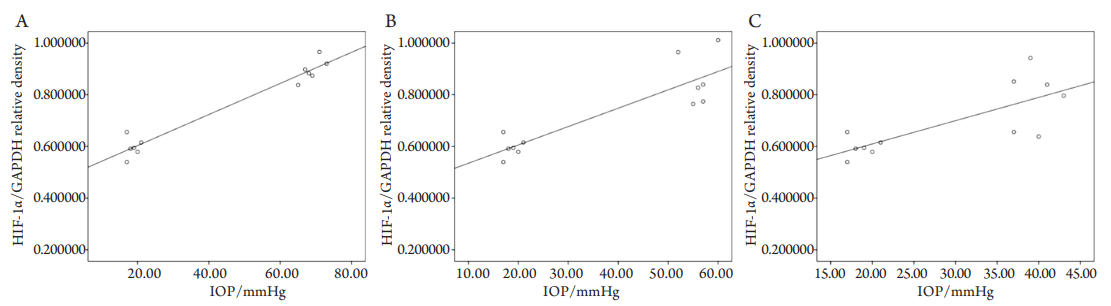

图6 HIF-1α的蛋白表达与眼压值的散点图
Figure 6 Scatter diagram of retinal HIF-1α protein and IOP
表示对照组与高眼压3天组(A)、高眼压7天组(B)、高眼压2周组(C)的HIF-1α的蛋白表达与眼压值成正相关关系。
Positive relationship of HIF-1α protein and IOP among the 3-day group (A), the 7-day group (B), the 2-week group (C) with the control respectively.
2.6 高眼压模型VEGF-A和EPO表达增多
在对照组,均可检测到VEGF-A和EPO;高眼压3天组与对照组相比,二者的表达差异具有统计学意义(P<0.01),均出现表达的高峰;随着高眼压的时间延长,二者开始逐渐降低,高眼压7天组的VEGF-A与对照组相比,差异无统计学意义(P>0.05),而EPO的表达差异仍具有统计学意义(P<0.05),说明EPO在高眼压作用下维持时间较VEGF-A长。高眼压2周组与高眼压3周组和对照组
相比,EPO的表达虽有增多,但差异无统计学意义(P<0.05,图7)。
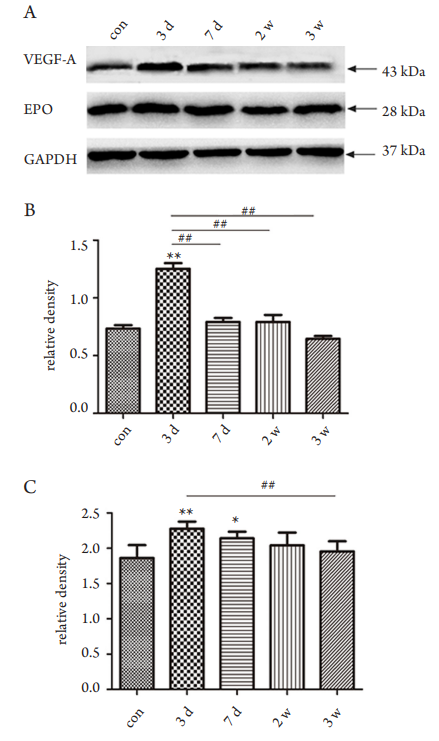

图7 高眼压模型和对照组视网膜组织VEGF-A和EPO的蛋白表达
Figure 7 Expression of retinal VEGF-A and EPO protein
between the IOH and control groups
以GAPDH为内参,进行数据统计分析。(A)Western印迹电
泳条带图;(B)VEGF-A条带灰度分析图;(C)EPO条带灰
度分析图。与对照组比较,**P<0.01;高眼压组间两两比
较,## P<0.01。
The GAPDH was taken as internal control and the grey value
was analyzed. (A) Band of Western blot; (B) Analysis of the grey
value of VEGF-A band; (C) Analysis of the grey value of EPO
band. Compared with the control group, **P<0.01; the multiple
comparisons among the IOH groups,
## P<0.01.
3 讨论
青光眼的视神经保护问题一直是眼科界研究的热点和难点,以往在机械压迫和自身免疫等方面
的研究虽有一定的进展,但仍无法完全逆转RGCs的凋亡和视野的衰退,说明其他因素也发挥着重要作用。青光眼患者存在视网膜血流下降毋庸置疑[11]。当组织萎缩的时候,血管会发生继发性变性[12];而在该病中能够观察到这种继发性血管改变,这是其中一个重要原因。在部分青光眼患者,当眼压维持较低水平时,视乳头处能够通过自身
调节维持血流的稳定,当眼压超过45或55 mmHg时,这种自身调节将被打破,眼部血流出现明显下降[13],说明眼压与缺血缺氧状态存在一定的关联。在组织缺氧的条件下,HIF-1α的降解受到抑制,它积聚在胞浆,与结构性亚基HIF-1β形成HIF-1二聚体并转移到细胞核,激活下游靶基因的表达,使细胞对缺氧的产生一系列适应性反应[3]。但是,HIF-1信号通路在高眼压模型中表达情况尚不明了。
EPO和VEGF-A是HIF-1下游的两个重要因子,二者均在神经保护和神经营养方面发挥着极其重要的作用[18-19]。在高眼压模型中,我们观察到EPO的蛋白表达水平上升趋势与HIF-1水的增多趋势基本相同,均在眼压升高早期上调,随着眼压下降逐渐减少。Fu等[20]也发现在慢性高眼压条件下,EPO的表达增多,不同的是,他们在眼压持续升高2周时才检测到EPO的上调,可能与它们模型的眼压值在前2周较低有关,说明EPO的表达可能同HIF-1同类似,在一定程度上随着眼压的升高而升高;此外,他们还发现EPOR同时增多,表明在此条件下,升高的内源性EPO和EPOR可以相互结合进而在起到了潜在的神经损伤修复作用。
本研究利用前房注射磁性微球法建立高眼压
动物模型,该模型在眼压升高3天和7天时RGCs虽有凋亡但不显著、而在2周和3周RGCs的凋亡
较明显且呈现逐渐递减趋势,与以往研究结果[14]类似,在一定程度上模拟青光眼的发病机制。通过对模型的检测发现:在适当条件下,HIF-1下的表达与眼压值呈现明显的正相关关系,即当眼压维持在较高状态(60~70 mmHg )时,才可检测到视网膜组织HIF-1α明显增多,而当眼压降低
(<40 mmHg)时,HIF-1α快速降解,说明HIF-1α的
积聚与高眼压的作用息息相关。这对前者的说法
也有补充,从不同层面阐释眼压与血流改变和缺
氧的关系。Rosenthal等[15]也说明高眼压能够直接引起眼部血流下降,导致眼部缺氧。随着缺氧时间的延长,如该模型中眼压升高3周时,虽然眼压仍较对照组升高,HIF-1较的表达却极少,可能因
为此时RGCs已大量凋亡、视网膜出现严重损伤、细胞丧失了激活此通路的能力。除高眼压的作用外,血管内皮产生的ET-1和NO也可直接作用于平滑肌细胞,引起正常眼压性青光眼患者的血管异常[16]。青光眼模型中视网膜组织缺血缺氧和HIF-1中表达增多已是不争的事实,Ergorul等[17]还发现它下游部分基因的mRNA水平上调,包括EPO,VEGF-A和HSP27等。HIF-1二聚体并转移到细胞核,激活下游靶基因的表达,使细胞对缺氧的产生一系列适应性反应[3]。但是,HIF-1信号通路在高眼压模型中表达情况尚不明了。
本研究发现VEGF-A的蛋白表达与HIF-1A的表达趋势和眼压的峰值同样存在一定的联系,随着HIF-1联的减少和眼压的降低,VEGF-A也迅速下降。研究[21]发现:外源性VEGF-A能够减轻缺氧诱导的视网膜损伤而且它对视网膜神经元起到了直接的保护效应;此外,VEGF-A通过与VEGFR-2结合减轻高眼压状态下RGCs的损伤,而对它的中和起相反作用,同时也表明它对急性模型RGCs的保护作用与PI3K信号通路的激活有关[22]。
此外,诱导型一氧化氮合成酶 (inducible
nitric oxide synthase,iNOS)和环氧化酶-2(cyclooxygenase-2,COX-2)也是HIF-1下游的重要因子,它们可通过诱导NO的合成和氧自由基的生成等来加剧缺氧状态下的神经损伤[23-24];与EPO和VEGF-A不同的是,在高眼压模型中,二者蛋白合成的高峰均滞后于HIF-1[25],提示HIF-1的激活可能在病程较早期瞬间启动保护性因子的表达,
而随着缺氧的持续作用,下游破坏性因子逐渐增多,保护作用被取代,RGCs的凋亡也逐渐加重。
综上所述,在高眼压动物模型中HIF-1物表达增多,尤其当眼压维持较高状态时,说明眼压值与组织缺氧情况存在一定程度的关联;早期增多的下游因子,如VEGF-A和EPO等,可使RGCs适应于短暂的缺氧环境,而后表达的损伤性因子却加重了病程,最终引起RGCs的不可逆性凋亡。由此可见,HIF-1信号通路在高眼压病程中是一把双刃剑,不同阶段的表达可能对视神经产生截然不同的效应,它的具体作用机制尚待进一步相关通路的抑制或激活实验对神经节细胞的影响来证实。
基金
暂无基金信息
参考文献
1. Harris A, Rechtman E, Siesky B, et al. The role of optic nerve blood flow in the pathogenesis of glaucoma[J]. Ophthalmol Clin North Am, 2005, 18(3): 345-353.
2. Correia SC, Moreira PI. Hypoxia-inducible factor 1: a new hope to counteract neurodegeneration?[J]. J Neurochem, 2010, 112(1): 1-12.
3. Courtnay R, Ngo DC, Malik N, et al. Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K[J]. Mol Biol Rep, 2015, 42(4): 841-851.
4. Savagian CA, Dubielzig RR, Nork TM. Comparison of the distribution of glial fibrillary acidic protein, heat shock protein 60, and hypoxiainducible factor-1alpha in retinas from glaucomatous and normal canine eyes[J]. Am J Vet Res, 2008, 69(2): 265-272.
5. Tezel G, Wa x MB. Hypoxia-inducible factor 1alpha in the glaucomatous retina and optic nerve head[J]. Arch Ophthalmol, 2004, 122(9): 1348-1356.
6. Zhu Y, Zhang L, Schmidt JF, et al. Glaucoma-induced degeneration of retinal ganglion cells prevented by hypoxic preconditioning: a model of glaucoma tolerance[J]. Mol Med, 2012, 18: 697-706.
7. Zhu Y, Zhang Y, Ojwang BA, et al. Long-term tolerance to retinal ischemia by repetitive hypoxic preconditioning: role of HIF-1alpha and heme oxygenase-1[J]. Invest Ophthalmol Vis Sci, 2007, 48(4): 1735-1743.
8. Gidday JM, Zhang L, Chiang CW, et al. Enhanced retinal ganglion cell survival in glaucoma by hypoxic postconditioning after disease onset[J]. Neurotherapeutics, 2015, 12(2): 502-514.
9. Taie S, Ono J, Iwanaga Y, et al. Hypoxia-inducible factor-1 alpha has a key role in hypoxic preconditioning[J]. J Clin Neurosci, 2009, 16(8): 1056-1060.
10. Sheridan CM, Pate S, Hiscott P, et al. Expression of hypoxiainducible factor-1alpha and -2alpha in human choroidal neovascular membranes[J]. Graefes Arch Clin Exp Ophthalmol, 2009, 247(10): 1361-1367.
11. Flammer J, Orgul S, Costa VP, et al. TTe impact of ocular blood flow in glaucoma[J]. Prog Retin Eye Res, 2002, 21(4): 359-393.
12. Fujino H, Kohzuki H, Takeda I, et al. Regression of capillary network in atrophied soleus muscle induced by hindlimb unweighting[J]. J Appl Physiol (1985), 2005, 98(4): 1407-1413.
13. Pillunat LE, Anderson DR, Knighton RW, et al. Autoregulation of human optic nerve head circulation in response to increased intraocular pressure[J]. Exp Eye Res, 1997, 64(5): 737-744.
14. Trost A, Motloch K, Bruckner D, et al. Time-dependent retinal ganglion cell loss, microglial activation and blood-retina-barrier tightness in an acute model of ocular hypertension[J]. Exp Eye Res, 2015, 136: 59-71.
15. Rosenthal R, Fromm M. Endothelin antagonism as an active principle for glaucoma therapy[J]. Br J Pharmacol, 2011, 162(4): 806-816.
16. Haefliger IO, Dettmann E, Liu R, et al. Potential role of nitric oxide and endothelin in the pathogenesis of glaucoma[J]. Surv Ophthalmol, 1999, 43(Suppl 1): S51-S58.
17. Ergorul C, Ray A, Huang W, et al. Hypoxia inducible factor-1alpha (HIF-1alpha) and some HIF-1 target genes are elevated in experimental glaucoma[J]. J Mol Neurosci, 2010, 42(2): 183-191.
18. Nekoui A, Blaise G. Erythropoietin and Nonhematopoietic Effects[J]. Am J Med Sci, 2017, 353(1): 76-81.
19. Jin KL, Mao XO, Greenberg DA. Vascular endothelial growth factor: direct neuroprotective effect in in vitro ischemia[J]. Proc Natl Acad Sci USA, 2000, 97(18): 10242-10247.
20. Fu QL, Wu W, Wang H, et al. Up-regulated endogenous erythropoietin/erythropoietin receptor system and exogenous erythropoietin rescue retinal ganglion cells after chronic ocular hypertension[J]. Cell Mol Neurobiol, 2008, 28(2): 317-329.
21. Nishijima K, Ng YS, Zhong L, et al. Vascular endothelial growth factor-A is a survival factor for retinal neurons and a critical neuroprotectant during the adaptive response to ischemic injury[J]. Am J Pathol, 2007, 171(1): 53-67.
22. Foxton RH, Finkelstein A, Vijay S, et al. VEGF-A is necessary and sufficient for retinal neuroprotection in models of experimental glaucoma[J]. Am J Pathol, 2013, 182(4): 1379-1390.
23. Hseu YC, Chen SC, Tsai PC, et al. Inhibition of cyclooxygenase-2 and induction of apoptosis in estrogen-nonresponsive breast cancer cells by Antrodia camphorata[J]. Food Chem Toxicol, 2007, 45(7): 1107-1115.
24. Neufeld AH. Pharmacologic neuroprotection with an inhibitor of nitric oxide synthase for the treatment of glaucoma[J]. Brain Res Bull, 2004, 62(6): 455-459.
25. Gui D, Li Y, Chen X, et al. HIF1 signaling pathway involving iNOS, COX2 and caspase9 mediates the neuroprotection provided by erythropoietin in the retina of chronic ocular hypertension rats[J]. Mol Med Rep, 2015, 11(2): 1490-1496.