慢性中心性浆液性脉络膜视网膜病变的多模式影像研究进展
阅读量:4935
DOI:10.12419/24102701
发布日期:2025-03-25
作者:
阿卜杜拉·萨伍提 ,苏钰 ,陈长征
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
慢性中心性浆液性脉络膜视网膜病变
多模式影像
综述
摘要
慢性中心性浆液性脉络膜视网膜病变(cCSC)以广泛的脉络膜视网膜异常为特征,包括脉络膜血管扩张及其引发的弥漫性视网膜色素上皮病变和浆液性视网膜脱离,常累及黄斑区,引起视功能损害。传统观点认为其可能由急性CSC演变而来,但近期研究显示两者在临床上存在明显差异。其病情反复、迁延,预后较差。随着光学相干断层扫描血管造影(OCTA)、超广角成像和en face重建成像等新多模式影像(MMI)技术的出现和人工智能及机器学习的发展,更多有意义的cCSC影像学特征不断出现。文章详细介绍了cCSC在眼底成像、眼底自发荧光(FAF)、光学相干断层扫描(OCT)、眼底荧光素血管造影(FFA)、吲哚菁绿血管造影和OCTA等影像技术中的表现,并探讨了人工智能在识别CSC分类及其OCT 生物标志物等方面的应用。不同影像技术在cCSC的诊断和研究中各有优势,如FAF可能是评估疾病进展及变化的有效手段,OCT可更直观地观察视网膜结构的改变,FFA是识别渗漏点的重要检查手段,而OCTA可能是评估脉络膜微循环的的最佳手段等。这些MMI研究进展为深入了解cCSC的病理生理机制及临床特征提供了重要线索,有助于提高诊断的准确性和效率,改善患者的预后和生活质量。
全文
文章亮点
1. 关键发现
• 通过广泛搜集阅读慢性中心性浆液性脉络膜视网膜病变相关的国内外研究,深入总结其多模式影像研究进展。
2. 已知与发现
• 慢性中心性浆液性脉络膜视网膜病变以广泛的脉络膜视网膜异常为特征,常累及黄斑区,病情反复、迁延,预后较差。• 随着多模式影像技术的发展和人工智能及机器学习的应用,更多有意义的慢性中心性浆液性脉络膜视网膜病变影像学特征不断涌现。
3. 意义与改变
• 深入了解慢性中心性浆液性脉络膜视网膜病变的多模式影像特征,能够为临床医生提供更全面的诊断和治疗参考。
慢性中心性浆液性脉络膜视网膜病变(chronic central serous chorioretinopathy, cCSC)曾被称为“弥漫性视网膜色素上皮病”[1],是一种以视网膜和脉络膜广泛异常为特征的眼科疾病。这些异常包括脉络膜血管扩张及其引发的弥漫性视网膜色素上皮(retinal pigment epithelium, RPE)病变和浆液性视网膜脱离(serous retinal detachment, SRD),常累及黄斑区,引起视功能损害。cCSC的病程反复且持续,视网膜下液(subretinal fluid, SRF)常持续超过4~6个月,导致光感受器受损,进而引起不可逆的中度至重度视力下降和光敏感性降低。传统观点认为cCSC可能由急性CSC(acute CSC, aCSC)演变而来,但近期的研究显示,只有少数cCSC患者有aCSC的病史,这表明aCSC和cCSC在临床上存在明显差异[2]。在CSC的发病机制中,脉络膜循环异常通常起着关键作用[2-5],光学相干断层扫描(optical coherence tomography, OCT)常能观察到以大血管层(Haller层)为主的脉络膜层增厚和血管扩张[6]。而在cCSC中,脉络膜循环的异常可能持续存在,最终导致外层视网膜的慢性损害。随着眼科多模式影像(multimodal imaging, MMI)技术与设备的不断进步和更新迭代,人工智能(artificial intelligence,AI)和机器学习的大数据更新,研究者对cCSC的病理生理机制及临床特征的认识也有所变化。现就cCSC的MMI特征及最新研究进展作一综述,为临床同道提供参考。
1 眼底成像
在眼底彩照中,cCSC通常表现出黄斑区的圆形或不规则点片状淡黄色色素改变,或视网膜下的灰黄色病灶,脱离缘还可见弧形光晕,中心凹反射常消失。然而,由于这些特征的界限并不总是清晰,仅凭眼底彩照在临床实践中诊断cCSC存在一定的挑战。深度学习可提高其检出率,Zhen等[7]通过深度学习分析了1329张CSC的眼底彩照特征,以诊断及鉴别aCSC与cCSC,其验证准确率可达89%,且与专家相比有更高的灵敏度和分类准确度。这表明,深度学习技术在通过眼底彩照筛查cCSC方面具有独特的潜力。
在多光谱眼底成像中,黄绿组合光谱像能够显示SRD的范围和脱离腔内的黄白色渗出。波长550~580 nm的光谱下,RPE异常或微撕裂部位可显示为一暗点,与眼底荧光素血管造影(fundus fluorescein angiography,FFA)的渗漏点位置一致。红光及红外光谱像可清晰显示RPE及脉络膜血管结构,在810 nm长波长下扩张的脉络膜血管更清晰,且与吲哚菁绿血管造影(indocyanine green angiography,ICGA)一致性良好[8]。炫彩眼底成像在识别SRF方面较FFA更有效,识别RPE脱离(RPE detachment,PED)和RPE弥漫性改变的能力也与FFA相当[9]。这些技术可以作为早期识别cCSC中SRD、PED、SRF,甚至渗漏点等异常影像学特征的无创检测手段。
2 眼底自发荧光
眼底自发荧光(fundus autofluorescence,FAF)包括蓝光AF (blue light AF,BLAF)和近红外波长AF(near infrared AF,NIRAF),BLAF更为常用,其主要产生荧光的物质是RPE细胞内的脂褐质。cCSC病灶的AF变化通常呈渐进性:初期多呈弥漫性强AF(图1A),这可能与早期SRF所覆盖区域的RPE尚未萎缩(图1B),代谢活性较高有关。部分患眼在早期可表现为局灶性强AF,这可能是由光感受器外节或巨噬细胞摄入脂褐质或其前体致脂褐质沉积所致。随着时间的推移,病灶可表现出颗粒状或椭圆形斑片状弱AF(图1C),这类弱AF病灶在OCT上可表现为RPE弥漫性萎缩(图1D),提示这些区域的RPE功能严重受损,患者视力预后通常较差[10]。晚期病灶还可呈现出重力轨迹样特征(图1C),这可能与SRF的慢性移动有关。这些弱AF病灶周边常有强AF围绕,这可能与病灶周边的RPE功能尚未受损有关[11-12]。这种渐进性改变表明,在cCSC病程中,RPE细胞代谢活性升高所致的脂褐质异常积累通常先于其退行性变化。因此,早期的强AF改变对晚期 RPE 的萎缩可能具有一定的预测价值。Framme 等[12]指出,在大约1/5存在持续性 SRF的 cCSC 患者中,可观察到与FFA中的渗漏点共定位的不规则强AF,这提示部分强AF可能与渗漏点的存在相关。
图1 cCSC患眼的超广角FAF及黄斑OCT表现
Figure 1 Characteristics of ultra-wide-field FAF and macular OCT in eyes with cCSC

(A) cCSC早期超广角FAF图像,表现出多个椭圆形强AF病灶;(B) cCSC早期黄斑区OCT B扫描图像,可见弥漫的SRF及一处PED;(C) cCSC晚期超广角FAF图像,可见大片不规则的弱AF病灶,周边强AF包绕,且呈重力轨迹样特征;(D) cCSC早期黄斑区OCT B扫描图像,可见与弱AF区域对应的RPE及外层视网膜萎缩,以及与强AF区域对应的少量SRF。
(A) Early-stage cCSC ultra-wide-feld FAF image showing multiple oval-shaped areas of hyper-AF; (B) Early-stage cCSC OCT B-scan image of the macula, demonstrating difuse SRF and a PED; (C) Late-stage cCSC ultra-wide-feld FAF image, revealing large irregular areas of hypo-AF surrounded by hyper-AF, with gravitational tract; (D) Early-stage cCSC OCT B-scan image of the macula, showing RPE and outer retinal atrophy corresponding to the areas of hypo-AF, as well as a small amount of SRF corresponding to the areas of hyper-AF.
NIRAF主要反映了脉络膜和RPE中黑色素的分布[13]。cCSC在NIRAF上主要表现为FAF渗漏点处弱AF,是由于渗漏点处光感受器和(或)RPE萎缩及RPE层缺损、黑色素减少所致。亦可见点状或颗粒状强AF,可能是因为:1)RPE层受损后释放黑色素并覆盖在视网膜下的聚合物表面;2)SRF中的纤维蛋白覆盖在聚合物表面;3)强荧光物质,如视网膜下出血后血液成分的分解,光感受器外节残存物质的积聚等[14-15]。这些特征表明,虽然NIRAF也能反映出RPE层的损伤,但在观察早期RPE代谢的增加方面不如BLAF。
有研究表明,超过50%的cCSC患者存在周边视网膜受累[16],因此超广角FAF在CSC的诊断及鉴别方面有较高的应用价值,可以更好地呈现周边视网膜受累情况,还可以更清晰地观察到病灶的重力轨迹样特征等。在57%使用超广角FAF的CSC病例(推测是慢性)的外周也发现了强AF损伤[17],这表明发生黄斑外SRD时,cCSC患者因症状不明显导致无法早期就诊。荧光寿命成像检眼镜可以在宏观水平上对内源性视网膜荧光团的寿命进行成像,cCSC的视网膜萎缩、瘢痕、视网膜下沉积物等改变常导致荧光寿命的延长[18],但因设备昂贵等原因,目前临床应用少。除了定性评估,FAF 灰度值还可用于定量评估病灶大小及变化,目前在小样本量中可行,但在临床上尚未广泛实施[19]。
3 OCT
在OCT上,cCSC通常表现多样,病程的长短、渗漏病灶的多少以及SRF的严重程度均有可能会影响外层视网膜的损伤程度。RPE萎缩是cCSC的特征之一,严重的cCSC患者通常表现为弥漫性RPE萎缩,且其范围随病程延长呈扩大趋势[20],这与持续存在的SRF以及脂褐质的过度积累对RPE细胞的损害有关。RPE萎缩在FAF中可表现为弱AF改变,在FFA中可表现出强荧光窗样缺损。但FAF和FFA可能会受到SRF的存在以及荧光素的渗漏等因素的干扰。而OCT可更加直观地呈现这种萎缩性改变(图1D)。cCSC还可出现黄斑中心凹外核层变薄,常见于SRF长期存在的患眼。此类患者即使SRF最终吸收,外核层的变薄也很难恢复,最终影响视功能[21]。
黄斑区囊样变性(cystoid macular degeneration,CMD)是cCSC的又一特征,其在OCT上表现为黄斑区视网膜囊样间隙,但在FFA上无对应的荧光素渗漏。CMD需与cCSC的另一罕见并发症黄斑区囊样水肿相鉴别,后者在FFA晚期可出现荧光素渗漏或积聚,且通常需要行抗血管内皮生长因子治疗[22-23]。在cCSC中,由于Haller层血管扩张并压迫内层脉络膜,导致脉络膜毛细血管(choriocapillaris,CC)出现局部缺血,这种改变可在光学相干断层扫描血管造影(optical coherence tomography angiography,OCTA)及ICGA中观察到。再加上持续存在SRF,可能会引起黄斑区及外层视网膜的缺血,进而导致外层血-视网膜屏障破坏,使得液体渗透进入视网膜内,形成CMD[22]。
cCSC还可见中等反射信号的扁平不规则PED。其在OCT上可呈现为RPE/Bruch膜复合体的"双层征":两个高反射层(一条起伏的RPE层和一条代表Bruch膜的高反射直线)和层间中低反射信号(图1B及图3B)[24]。这与息肉样脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)患者的"双层征"不同,PCV层间通常为强反射信号,两者可通过OCTA或ICGA进一步鉴别。PED的位置通常与FFA中的渗漏点以及ICGA中的高荧光改变区域相对应,且通常位于周边扩张的涡静脉区域[25]。因此,PED的存在可能提示cCSC患眼仍处于活动性渗漏状态。
cCSC在OCT上还可观察到视网膜及脉络膜内的高反射病灶。视网膜内的高反射病灶多由蛋白质、光感受器外节的巨噬细胞、外渗脂质或活化的小胶质细胞等组成。高反射病灶的数量通常与 SRF 持续时间较长、视力恢复较慢和复发概率增加相关[26]。脉络膜高反射点可能是由于脉络膜循环的细胞外渗所致,其发展被认为和脉络膜结构的长期重塑有关[27],在CSC中常见,通常与SRD的高度、中心凹下脉络膜厚度、黄斑区视网膜厚度等相关。但cCSC中的脉络膜高反射点计数显著少于aCSC。
近期,Hansraj等[28]描述了一种新的cCSC生物标志物,并称之为内层脉络膜纤维化,在OCT上表现为内层脉络膜中的中高反射病灶,被认为是内层脉络膜的退行性改变,与眼底照相上的黄白色视网膜下病灶相对应,通常与更差的预后相关。cCSC也可存在Fuji 征,即SRF边缘呈潜掘性发展、类似富士山形(图2),其存在可作为SRF自发消退的预测因子[29-31],以指导此类患者的临床决策。
图2 Fuji 征
Figure 2 Fuji sign

Fuji 征阳性:在黄斑区横向B扫描图像上,从SRF最高点处椭圆体带出发,向中心凹处的Bruch膜做垂线段,并以该线段中点处的垂线作为三角形的底边。以SRF最高点处外界膜为顶点,底边与两侧外界膜交点为底点作三角形的腰,若外界膜在三角形腰的下方或与其重叠,则为阳性。该患眼外界膜在三角形的下方,为Fuji征阳性。
Positive Fuji sign: on a foveal horizontal OCT scan, a line was drawn from the innermost part of the ellipsoid zone to the Bruch membrane . Te base of the triangle was drawn halfway and perpendicular to this line. Te 2 legs of the triangle were drawn from the external limiting membrane, at the apex of the SRF, to the 2 points where the baseline intersected with the external limiting membrane. Te Fuji sign was considered to be positive when the external limiting membrane was positioned either exactly overlapping the 2 legs of the triangle or under these lines. In this eye, the external limiting membrane was positioned under the legs, which was considered to be positive Fuji sign.
频谱/频域深度增强OCT(enhanced depth imaging-OCT,EDI-OCT)和扫频OCT(sweep source-OCT,SS-OCT)可更好地评估脉络膜结构。cCSC患者的脉络膜增厚明显,但较aCSC薄,且这种增厚在黄斑鼻侧更显著[32]。而Haller层增厚是导致脉络膜增厚的主要原因,是比总脉络膜厚度更灵敏的生物标志物[6]。Rijssen 等[33]研究表明,未经治疗的cCSC 中患眼和对侧眼之间的脉络膜厚度比较差异无统计学意义,提示cCSC患者的对侧眼也需关注随访。因此,cCSC也属于肥厚型脉络膜疾病谱。肥厚型脉络膜疾病是指病程中出现特征性的脉络膜Haller层血管扩张,导致脉络膜厚度局灶性或弥漫性增厚,且CC层和中血管层不同程度变薄,伴或不伴RPE屏障功能受损及其下方血管壁异常增厚性病变的一系列疾病[34]。在 ICGA 及en face OCT图像上也可更加直观地观察到这些相对笔直和扩张的脉络膜血管。而且关于en face OCT图像的研究也表明,这种血管扩张主要是在Haller层。在CC层或中血管层的图像所见的扩张脉络膜血管也多起源于Haller层[35]。Matsumoto等[36]通过分析en face OCT 图像,发现不同涡静脉系统之间存在吻合。这也在ICGA中得到了进一步证实[37]。
眼前节OCT可以评估巩膜厚度。有研究者认为涡静脉中脉络膜流出道的血管阻力和充血可能受到巩膜厚度和刚度的调节,其研究发现CSC 患者的前巩膜厚度 (anterior scleral thickness,AST) 显著增加,且在非糖皮质激素诱导的CSC中更为显著[38-40]。这表明AST在CSC的病理机制中起着重要作用,但目前仍缺乏针对cCSC的AST特征的研究。
AI在识别CSC的分类及其OCT生物标志物等方面具有独特的优势。有研究表明,AI诊断和区分aCSC与cCSC的能力与眼科医生相当或更好[41-42]。Desideri等[43-44]利用AI识别并分析了CSC患眼的OCT生物标志物,发现AI能够有效识别出高反射病灶以及扁平不规则PED,且基线时存在中心凹扁平 PED 和多个中心凹和中心凹外扁平 PED 的患者发展为cCSC的可能性更高。但该模型无法根据基线时的OCT有效区分aCSC与cCSC。他们还定量分析了PED的体积,但两组间PED的体积比较差异无统计学意义。Xu等[45]还基于AI构建了可以快速识别CSC病灶直径的模型,这在判断疾病严重程度及评价相应治疗效果等方面中具有重要意义。
4 FFA
cCSC常存在弥漫性 RPE病变(diffuse retinal pigment epitheliopathy,DRPE)伴大面积浆液性视网膜损伤。DRPE包括RPE层的渗漏点、RPE萎缩、PED、RPE增生及RPE下陈旧纤维素性渗出等。SRF被认为是起源于RPE层的渗漏点,PED则被认为是SRF从CC渗漏到视网膜下隙的中间过程[25]。而SRF的长期存在可能会导致RPE萎缩等退行性病变。因此,渗漏点的识别与早期干预至关重要,FFA是识别渗漏点的重要检查手段。cCSC在FFA晚期可见多个模糊不清的局灶性渗漏或弥漫性渗漏,通常呈重力轨迹样特征(图3A),这与aCSC中更常见的墨迹样渗漏(图3C)不同。但不同渗漏类型的cCSC患者间并无明显的临床特征差异。渗漏病灶在中期和晚期还可出现颗粒状或斑驳的强荧光斑块。RPE萎缩的区域通常呈强荧光窗样缺损(图3A红箭头所指)[2, 46-47],这种强荧光改变可用OCT来辅助鉴别(图3B)。RPE增生及RPE下陈旧纤维素性渗出的部位在FFA中始终呈遮蔽性弱荧光。DRPE的范围可用来确定病变的严重性,黄斑区累计DRPE范围超过5个视盘直径被认为是重度cCSC[20]。因此,FFA在评估cCSC严重程度和活动性方面发挥着一定作用。
图3 cCSC及aCSC患眼的FFA及OCT特征
Figure 3 FFA and OCT characteristics of CSC eyes

(A, B) cCSC患眼的FFA及黄斑区OCT 特征,在FFA上表现为多个局灶性渗漏,与一渗漏点对应的OCT中可见不典型“双层征“伴小PED(蓝箭头)。FFA还表现出与OCT中RPE萎缩区域相对应的强荧光窗样缺损(红箭头);(C, D) aCSC患眼的FFA及黄斑区OCT特征,在FFA中可见墨迹样局灶性渗漏(黄箭头),在OCT上可见与渗漏处对应的浆液性PED(黄箭头)。
(A, B) Te FFA and macular OCT features of cCSC eye. Te FFA showed multiple focal leakages, and macular OCT showed a PED "double-layer sign"(blue arrows) corresponding to a leakage point. Tere were also hyperfuorescent window defects corresponding to areas of RPE atrophy (red arrows); (C, D) Te FFA and macular OCT features of aCSC eye. Te FFA showed an ink-blot focal leakage corresponding to the PED "double-layer sign"(yellow arrows) on macular OCT.
5 ICGA
ICGA在CSC的诊断、治疗及其与脉络膜新生血管(choroidal neovascularization,CNV)的鉴别中应用广泛[48]。CNV中脂蛋白结合受体的增加可使与脂蛋白结合的吲哚菁绿积累,在ICGA晚期可表现为强荧光斑块。因此ICGA在发现隐匿性CNV方面有一定潜力[49]。在ICGA中,由多个区域的脉络膜高通透性引起的短暂性强荧光是cCSC的特征,这种强荧光在中期增强,在晚期减弱。在视网膜未受影响的区域和对侧眼中也可观察到这种强荧光斑点,表明脉络膜高通透性参与了 CSC 的发病机制[46, 50]。除了脉络膜血管扩张以外,CSC在ICGA早期还可出现低CC充盈延迟。而cCSC 的CC充盈延迟在晚期也持续存在,表明CC持续闭塞,这可能是由于弥漫性Haller层血管扩张压迫所致[51]。还有研究显示,CC充盈延迟区域与 en face图像中扩张的优势涡静脉区域相对应,但在cCSC中,两区域的重叠程度显著低于aCSC,且扩张涡静脉的不对称性表现也没有aCSC常见[52]。这可能与脉络膜血管的解剖结构及病理生理变化密切相关。不同于多数静脉,脉络膜静脉系统表现为数十条血管独立地流向各自的涡静脉壶腹,且相邻涡静脉系统间的交通很少。但在CSC 中,可能会存在血管吻合,此类患眼中的吻合血管主要位于黄斑区,且黄斑区通常没有正常的脉络膜静脉残留[37]。这种不同涡静脉系统间的吻合对涡静脉的不对称扩张起到一定的代偿作用。血管的重塑通常是一个慢性的过程,因此这种代偿作用可能在cCSC中更易发生,进而使cCSC表现出相比aCSC更少的涡静脉不对称现象、更薄的脉络膜厚度以及更为弥漫的视网膜脉络膜病变。aCSC 可能是由单个血管吻合引起的,这通常可自发闭塞,SRF也可完全消退,但仍有可能复发。但在cCSC中,血管吻合可能是持续存在的,且可能存在多个吻合,这种慢性持续的静脉超负荷可能会随着时间的推移导致更广泛的损伤[53]。
随着超广角ICGA的应用,有研究者发现扩张的脉络膜血管在离开巩膜前沿整个血管延伸至一个或多个涡静脉壶腹部,提示可能存在涡静脉流出巩膜时可能受阻[54]。而在传统视野ICGA上观察到的后极部脉络膜扩张血管可能是这些回流受阻的涡静脉分支。这些因流出受阻而扩张的静脉及吻合血管,会增加CC的流出压力,导致CC渗漏和损伤,这可能是除了压迫以外,又一个导致CC损伤的主要原因。CSC患者通常眼轴较短,且前节OCT的研究显示AST显著增厚。虽然后巩膜厚度暂时无法测量,但假设其与AST成正比,这种增厚会导致涡静脉在巩膜内的流出段延长,从而增强巩膜出口处的 Starling 电阻器效应,进一步加重流出道受阻。这可能会增加脉络膜静脉压和血管通透性,使液体渗出量增加,而且增厚的巩膜对液体的通透性也有所降低,这也会进一步加重液体的积聚,使液体在RPE水平渗漏进视网膜下隙,促进SRF的形成[37]。
6 OCTA
迄今为止,已有许多研究使用 OCTA 分析了CSC的视网膜脉络膜微循环[55-59] 。cCSC在OCTA上常呈现出CC层强血流信号区包绕弱血流信号区的血流模式,提示存在局灶性 CC 低灌注合并周围区域的高灌注 [57]。Hu等[60]结合en face OCTA将 CC异常分为3类(图4):1)粗颗粒状高反射区域。该区域与ICGA上的强荧光脉络膜高通透性区域相对应,且面积较后者大,这类异常可能是由CC流出受阻所致的扩张和血流增加引起的。但cCSC的RPE 萎缩也可能呈现A类异常,需谨慎分析;2)包绕着A类异常的规则圆形或椭圆形低反射光晕,可能是由 SRF 的阴影效应引起的;3)粗颗粒状低反射区域,最常见,与早期 ICGA 上的弱荧光充盈缺损区域相对应,且面积也较其大,这可能是由于CC受压迫引起的低灌注所致。C类异常与PED等引起的伪影可结合对应区域的B扫描图像鉴别。这些异常可能会导致有孔 CC 内的静水压增加、SRF 积聚和视网膜脉络膜的慢性缺氧损伤。由于ICGA检查是有创操作,且其可能会受因RPE萎缩所致的窗样缺损以及脉络膜高通透性所致的染料渗漏等因素的影响,OCTA可能是评估CC异常及其形态变化的最佳手段。OCTA 中的A类异常与 ICGA 中的高通透区非常吻合,这也提示OCTA有着替代ICGA来指导光动力疗法治疗的潜力。有研究者通过广角OCTA分析了CSC患者的CC密度,发现黄斑区患眼的CC密度介于健康患者的CC密度与CSC患者对侧眼的密度之间[61],结合OCT中对侧眼脉络膜厚度也显著增厚,可能单纯的脉络膜增厚与CC密度增加并不足以引起CSC。扫频OCTA被认为是目前检出cCSC继发CNV的最佳选择,它可以通过分层成像提高CNV检出的灵敏度[59]。OCTA还能通过区分OCT中的“双层征”层间信号是否存在血管成分来鉴别cCSC与PCV。
图 4 OCTA中的3类主要异常
Figure 4 Tree main types of abnormalities in OCTA
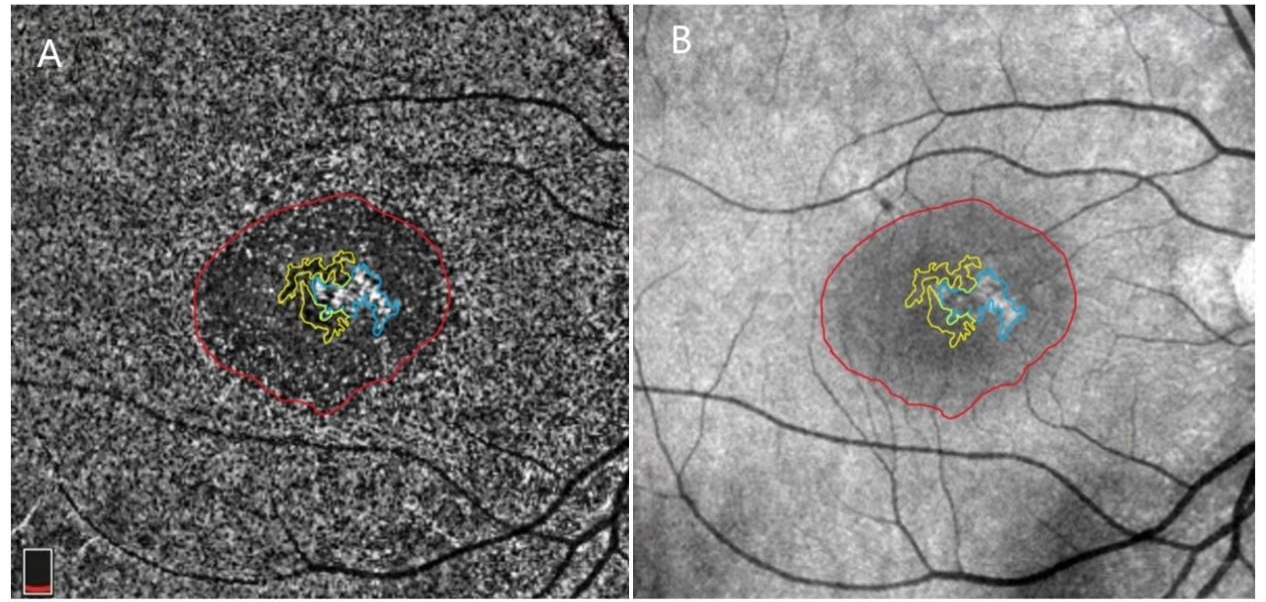
(A) En face OCT image of CC layer. Type A (outlined in blue), was defned as coarse granulated high refective area; type B (outlined in red) was defned as the roundish dark halo around type A; and type C (outlined in yellow) was defned as the coarse granulated low refective area. (B) IR image of the same eye. Type C abnormalities were not clear.
7 总结与展望
cCSC是一种具有挑战性的脉络膜视网膜疾病。MMI技术的发展与应用为了解其病理生理机制及临床特征提供了重要线索。未来,仍需进一步分析cCSC在各项新的影像学技术中的特征、各种影像学特征间的相关性,以及进一步探索其与aCSC、其他肥厚型脉络膜疾病等的区别。同时不同影像技术的分辨率和算法也有待进一步改进。AI技术在影像学中的发展和应用也为cCSC的研究提供了有益的工具,有利于更精准地判断脉络膜视网膜的状态,有望为患者的预后和生活质量改善提供更多的科学依据和思路。
声明
作者未使用任何生成式人工智能(GenAI)工具或服务。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。
基金
暂无基金信息
参考文献
1. Yannuzzi LA, Slakter JS, Kaufman SR, et al. Laser treatment of diffuse
retinal pigment epitheliopathy[ J]. Eur J Ophthalmol, 1992, 2(3): 103-
114. DOI: 10.1177/112067219200200301
2. van Rijssen TJ, van Dijk EHC, Yzer S, et al. Central serous
chor ioret inopathy: Toward s an ev idence-based treatment
guideline[ J]. Prog Retin Eye Res, 2019, 73: 100770. DOI: 10.1016/
j.preteyeres.2019.07.003.
3. Nkrumah G, Paez-Escamilla M, Singh SR , et al. Biomarkers for
central serous chorioretinopathy[ J]. Ther Adv Ophthalmol, 2020, 12:
2515841420950846. DOI: 10.1177/2515841420950846.
4. Christou EE, Stavrakas P, Kozobolis V, et al. Evaluation of the
choriocapillaris after photodynamic therapy for chronic central
serous chorioretinopathy. A review of optical coherence tomography
angiography (OCT-A) studies[ J]. Graefes Arch Clin Exp Ophthalmol,
2022, 260(6): 1823-1835. DOI: 10.1007/s00417-022-05563-3.
5. Daruich A, Matet A, Dirani A, et al. Central serous chorioretinopathy:
Recent findings and new physiopathology hypothesis[ J]. Prog Retin
Eye Res, 2015, 48: 82-118. DOI: 10.1016/j.preteyeres.2015.05.003
6. Uppugunduri SR , Rasheed MA, Richhariya A, et al. Automated
quantification of Haller's layer in choroid using swept-source optical
coherence tomography[ J]. PLoS One, 2018, 13(3): e0193324. DOI:
10.1371/journal.pone.0193324.
7. Zhen Y, Chen H, Zhang X, et al. Assessment of central serous
chorioretinopathy depicted on color fundus photographs using
deep learning[ J]. Retina, 2020, 40(8): 1558-1564. DOI: 10.1097/
IAE.0000000000002621.
8. 金恩忠, 赵明威, 钱彤. 中心性浆液性脉络膜视网膜病变的多模
式影像研究进展[ J]. 中华眼底病杂志, 2023, 39(4): 341-346. DOI:
10.3760/cma.j.cn511434-20230306-00106.
9. Venkatesh R, Agarwal SK, Bavaharan B, et al. Multicolour imaging in
central serous chorioretinopathy[ J]. Clin Exp Optom, 2020, 103(3):
324-331. DOI: 10.1111/cxo.12965.
10. Han J, Cho NS, Kim K, et al. Fundus autofluorescence patterns in
central serous chorioretinopathy[ J]. Retina, 2020, 40(7): 1387-1394.
DOI: 10.1097/IAE.0000000000002580
11. Zola M, Chatziralli I, Menon D, et al. Evolution of f undus
autofluorescence patterns over time in patients with chronic central
serous chorioretinopathy[ J]. Acta Ophthalmol, 2018, 96(7):
e835-e839. DOI: 10.1111/aos.13742.
12. Framme C, Walter A, Gabler B, et al. Fundus autofluorescence in
acute and chronic-recurrent central serous chorioretinopathy[ J]. Acta
Ophthalmol Scand, 2005, 83(2): 161-167. DOI: 10.1111/j.1600-
0420.2005.00442.x.
13. Iacono P, Battaglia PM, Papayannis A, et al. Acute central serous
chorioretinopathy: a correlation study between fundus autofluorescence
and spectral-domain OCT[ J]. Graefes Arch Clin Exp Ophthalmol,
2015, 253(11): 1889-1897. DOI: 10.1007/s00417-014-2899-5.
14. Weinberger AWA, Lappas A, Kirschkamp T, et al. Fundus near infrared
fluorescence correlates with fundus near infrared reflectance[ J]. Invest
Ophthalmol Vis Sci, 2006, 47(7): 3098-3108. DOI: 10.1167/iovs.05-
1104
15. Ayata A, Tatlipinar S, Kar T, et al. Near-infrared and short-wavelength
autofluorescence imaging in central serous chorioretinopathy[ J]. Br J
Ophthalmol, 2009, 93(1): 79-82. DOI: 10.1136/bjo.2008.141564.
16. Pang CE, Shah VP, Sarraf D, et al. Ultra-widefield imaging with
autofluorescence and indocyanine green angiography in central serous
chorioretinopathy[ J]. Am J Ophthalmol, 2014, 158(2): 362-371.e2.DOI: 10.1016/j.ajo.2014.04.021.
17. Mohabati D, Boon CJF, Hoyng CB, et al. Fundus autofluorescence
abnormalities can predict fluorescein angiography abnormalities in
patients with chronic central serous chorioretinopathy[ J]. Graefes
Arch Clin Exp Ophthalmol, 2023, 261(9): 2489-2495. DOI: 10.1007/
s00417-023-06042-z
18. Dysli C, Berger L, Wolf S, et al. Fundus autofluorescence lifetimes and
central serous chorioretinopathy[ J]. Retina, 2017, 37(11): 2151-2161.
DOI: 10.1097/IAE.0000000000001452.
19. Stattin M, Hagen S, Ahmed D, et al. Long-term effect of half-fluence
photodynamic therapy on fundus autofluorescence in acute central
serous chorioretinopathy[ J]. J Ophthalmol, 2020, 2020: 8491712.
DOI: 10.1155/2020/8491712.
20. Mohabati D, van Rijssen TJ, van Dijk EH, et al. Clinical characteristics
and long-term visual outcome of severe phenotypes of chronic central
serous chorioretinopathy[ J]. Clin Ophthalmol, 2018, 12: 1061-1070.
DOI: 10.2147/OPTH.S160956.
21. Deng K, Gui Y, Cai Y, et al. Changes in the foveal outer nuclear layer of
central serous chorioretinopathy patients over the disease course and
their response to photodynamic therapy[ J]. Front Med (Lausanne),
2021, 8: 824239. DOI: 10.3389/fmed.2021.824239
22. Iida T, Yannuzzi LA, Spaide RF, et al. Cystoid macular degeneration
in chronic central serous chorioretinopathy[ J]. Retina, 2003, 23(1):
1-7;quiz 137-138. DOI: 10.1097/00006982-200302000-00001.
23. Gorhe S, Chugh MK , Goel N, et al. Clinical feature of cystoid
macular degeneration in central serous chorioretinopathy[ J]. Indian
J Ophthalmol, 2023, 71(11): 3489-3493. DOI: 10.4103/IJO.
IJO_255_23.
24. Yang L, Jonas JB, Wei W. Optical coherence tomography-assisted
enhanced depth imaging of central serous chorioretinopathy[ J]. Invest
Ophthalmol Vis Sci, 2013, 54(7): 4659-4665. DOI: 10.1167/iovs.12-
10991.
25. Kogo T, Muraoka Y, Ishikura M, et al. Pigment epithelial detachment
and leak point locations in central serous chorioretinopathy[ J]. Am J
Ophthalmol, 2024, 261: 19-27. DOI: 10.1016/j.ajo.2024.01.012
26. Lee H, Lee J, Chung H, et al. Baseline spectral domain optical coherence
tomographic hyperreflective foci as a predictor of visual outcome and
recurrence for central serous chorioretinopathy[ J]. Retina, 2016,
36(7): 1372-1380. DOI: 10.1097/IAE.0000000000000929.
27. Hanumunthadu D, Matet A, Rasheed MA, et al. Evaluation of
choroidal hyperreflective dots in acute and chronic central serous
chorioretinopathy[ J]. Indian J Ophthalmol, 2019, 67(11): 1850-1854.
DOI: 10.4103/ijo.IJO_2030_18.
28. Hansraj S, Chhablani J, Behera UC, et al. Inner choroidal fibrosis: an
optical coherence tomography biomarker of severity in chronic central
serous chorioretinopathy[ J]. Am J Ophthalmol, 2024, 264: 17-24.
DOI: 10.1016/j.ajo.2024.02.025.
29. Pérez-García P, Oribio-Quinto C, Gómez-Calleja V, et al. Fuji sign:
Prevalence and predictive power to photodynamic therapy in chronic
central serous chorioretinopathy[ J]. Photodiagnosis Photodyn Ther,
2023, 42: 103316. DOI: 10.1016/j.pdpdt.2023.103316.
30. Feenstra HMA, Hensman J, Gkika T, et al. Spontaneous resolution of
chronic central serous chorioretinopathy: “fuji sign”[ J]. Ophthalmol
Retina, 2022, 6(9): 861-863. DOI: 10.1016/j.oret.2022.04.023.
31. Hanumunthadu D, van Dijk EHC, Dumpala S, et al. Evaluation of
choroidal layer thickness in central serous chorioretinopathy[ J].
J Ophthalmic Vis Res, 2019, 14(2): 164-170. DOI: 10.4103/jovr.
jovr_152_17.
32. Chakraborti C, Samanta SK, Faiduddin K, et al. Bilateral central serous
chorio-retinopathy in pregnancy presenting with severe visual loss[ J].
Nepal J Ophthalmol, 2014, 6(2): 220-223. DOI: 10.3126/nepjoph.
v6i2.11711.
33. 尹心恺, 戴荣平. 肥厚型脉络膜疾病研究现状及展望[ J]. 中华
实验眼科杂志, 2021, 39(1): 78-83. DOI: 10.3760/cma.j.cn115989-
20200706-00478.
34. Lee WJ, Lee JW, Park SH, et al. En face choroidal vascular feature
imaging in acute and chronic central serous chorioretinopathy using
swept source optical coherence tomography[ J]. Br J Ophthalmol, 2017,
101(5): 580-586. DOI: 10.1136/bjophthalmol-2016-308428.
35. Matsumoto H, Hoshino J, Mukai R, et al. Vortex vein anastomosis at
the watershed in pachychoroid spectrum diseases[ J]. Ophthalmol
Retina, 2020, 4(9): 938-945. DOI: 10.1016/j.oret.2020.03.024
36. Spaide RF, Gemmy Cheung CM, Matsumoto H, et al. Venous
overload choroidopathy: a hypothetical framework for central serous
chorioretinopathy and allied disorders[ J]. Prog Retin Eye Res, 2022,
86: 100973. DOI: 10.1016/j.preteyeres.2021.100973.
37. Imanaga N, Terao N, Nakamine S, et al. Scleral thickness in central
serous chorioretinopathy[ J]. Ophthalmol Retina, 2021, 5(3): 285-291.
DOI: 10.1016/j.oret.2020.07.011.
38. Fernández-Vigo JI, Moreno-Morillo FJ, Shi H, et al. Assessment of the
anterior scleral thickness in central serous chorioretinopathy patients
by optical coherence tomography[ J]. Jpn J Ophthalmol, 2021, 65(6):
769-776. DOI: 10.1007/s10384-021-00870-4.
39. Sawaguchi S, Terao N, Imanaga N, et al. Scleral thickness in steroid-induced central serous chorioretinopathy[ J]. Ophthalmol Sci, 2022,
2(2): 100124. DOI: 10.1016/j.xops.2022.100124.
40. Yoon J, Han J, Park JI, et al. Optical coherence tomography-based deeplearning model for detecting central serous chorioretinopathy[ J]. Sci
Rep, 2020, 10(1): 18852. DOI: 10.1038/s41598-020-75816-w.
41. Ko J, Han J, Yoon J, et al. Assessing central serous chorioretinopathy
with deep learning and multiple optical coherence tomography
images[ J]. Sci Rep, 2022, 12(1): 1831. DOI: 10.1038/s41598-022-
05051-y.
42. Desideri LF, Anguita R, Berger LE, et al. Analysis of optical coherence
tomography biomarker probability detection in central serous
chorioretinopathy by using an artificial intelligence-based biomarker
detector[ J]. Int J Retina Vitreous, 2024, 10(1): 42. DOI: 10.1186/
s40942-024-00560-6.
43. Desideri LF, Scandella D, Berger L, et al. Prediction of chronic central
serous chorioretinopathy through combined manual annotation
and AI-assisted volume measurement of flat irregular pigment
epithelium[ J]. Ophthalmologica, 2024. DOI: 10.1159/000538543.
44. Xu J, Shen J, Wan C, et al. An automatic image processing method
based on artificial intelligence for locating the key boundary points
in the central serous chorioretinopathy lesion area[ J]. Comput Intell
Neurosci, 2023, 2023: 1839387. DOI: 10.1155/2023/1839387
45. Ho M, Li G, Mak A, et al. Applications of multimodal imaging in
central serous chorioretinopathy evaluation[ J]. J Ophthalmol, 2021,
2021: 9929864. DOI: 10.1155/2021/9929864.
46. Yannuzzi LA, Shakin JL, Fisher YL, et al. Peripheral retinal detachments
and retinal pigment epithelial atrophic tracts secondary to central
serous pigment epitheliopathy[ J]. Ophthalmology, 1984, 91(12):
1554-1572. DOI: 10.1016/s0161-6420(84)34117-3
47. Yannuzzi LA. Indocyanine green angiography: a perspective on use in
the clinical setting[ J]. Am J Ophthalmol, 2011, 151(5): 745-751.e1.
DOI: 10.1016/j.ajo.2011.01.043.
48. Borrelli E, Vigano C, Battista M, et al. Individual vs.
combined imaging modalities for diagnosing neovascular
central serous chorioretinopathy. Graefes Arch Clin Exp
Ophthalmol. 2023 May;261(5):1267-1273. DOI: 10.1007/s00417-
022-05924-y.
49. Gajdzik-Gajdecka U, Dorecka M, Nita E, et al. Indocyanine green
angiography in chronic central serous chorioretinopathy[ J]. Med Sci
Monit, 2012, 18(2): CR51-CR57. DOI: 10.12659/msm.882455.
50. Kishi S, Matsumoto H. A new insight into pachychoroid diseases:
Remodeling of choroidal vasculature[ J]. Graefes Arch Clin Exp
Ophthalmol, 2022, 260(11): 3405-3417. DOI: 10.1007/s00417-022-05687-6.
51. Kishi S, Matsumoto H, Sonoda S, et al. Geographic filling delay of
the choriocapillaris in the region of dilated asymmetric vortex veins
in central serous chorioretinopathy[ J]. PLoS One, 2018, 13(11):
e0206646. DOI: 10.1371/journal.pone.0206646.
52. Brinks J, van Dijk EHC, Meijer OC, et al. Choroidal arteriovenous
anastomoses: a hypothesis for the pathogenesis of central serous
chorioretinopathy and other pachychoroid disease spectrum
abnormalities[ J]. Acta Ophthalmol, 2022, 100(8): 946-959. DOI:
10.1111/aos.15112.
53. Nicolò M, Rosa R, Musetti D, et al. Choroidal vascular flow area in
central serous chorioretinopathy using swept-source optical coherence
tomography angiography[ J]. Invest Ophthalmol Vis Sci, 2017, 58(4):
2002-2010. DOI: 10.1167/iovs.17-21417.
54. Chan SY, Wang Q, Wei WB, et al. Optical coherence tomographic
angiography in central serous chorioretinopathy[ J]. Retina, 2016,
36(11): 2051-2058. DOI: 10.1097/IAE.0000000000001064.
55. Teussink MM, Breukink MB, van Grinsven MJJP, et al. OCT
angiography compared to fluorescein and indocyanine green
angiography in chronic central serous chorioretinopathy[ J]. Invest
Ophthalmol Vis Sci, 2015, 56(9): 5229-5237. DOI: 10.1167/iovs.15-
17140
56. Demirel S, Yanık Ö, Nalcı H, et al. The use of optical coherence
tomography angiography in pachychoroid spectrum diseases: a
concurrent comparison with dye angiography[ J]. Graefes Arch Clin
Exp Ophthalmol, 2017, 255(12): 2317-2324. DOI: 10.1007/s00417-
017-3793-8.
57. Quaranta-El Maftouhi M, El Maftouhi A, Eandi CM. Chronic central
serous chorioretinopathy imaged by optical coherence tomographic
angiography[ J]. Am J Ophthalmol, 2015, 160(3): 581-587.e1. DOI:
10.1016/j.ajo.2015.06.016
58. Hu J, Qu J, Piao Z, et al. Optical coherence tomography angiography
compared with indocyanine green angiography in central serous
chorioretinopathy[ J]. Sci Rep, 2019, 9(1): 6149. DOI: 10.1038/
s41598-019-42623-x.
59. Meng Y, Xu Y, Li L, et al. Wide-field OCT-angiography assessment of
choroidal thickness and choriocapillaris in eyes with central serous
chorioretinopathy[ J]. Front Physiol, 2022, 13: 1008038. DOI:
10.3389/fphys.2022.1008038.