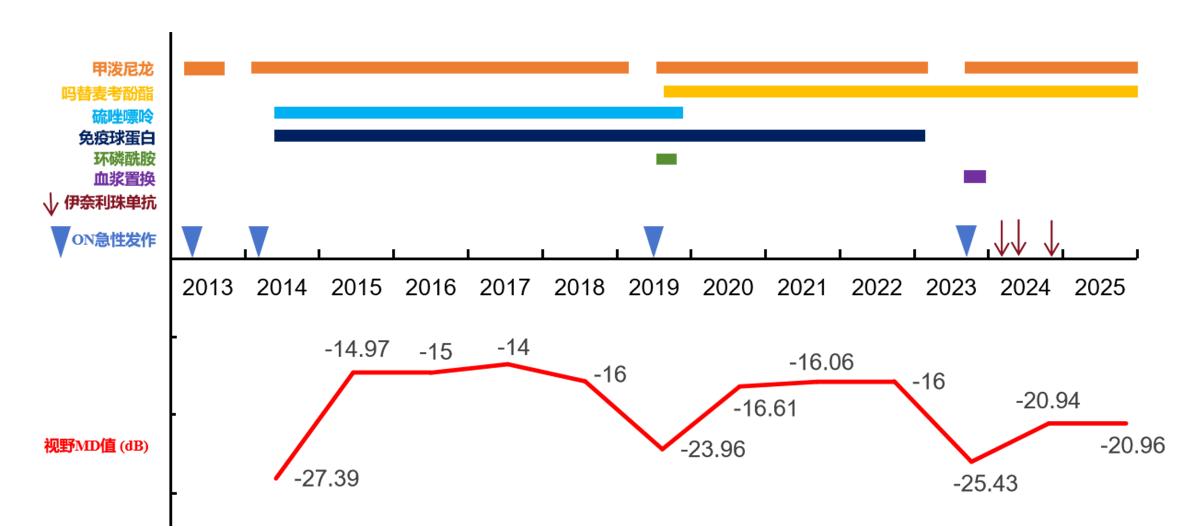
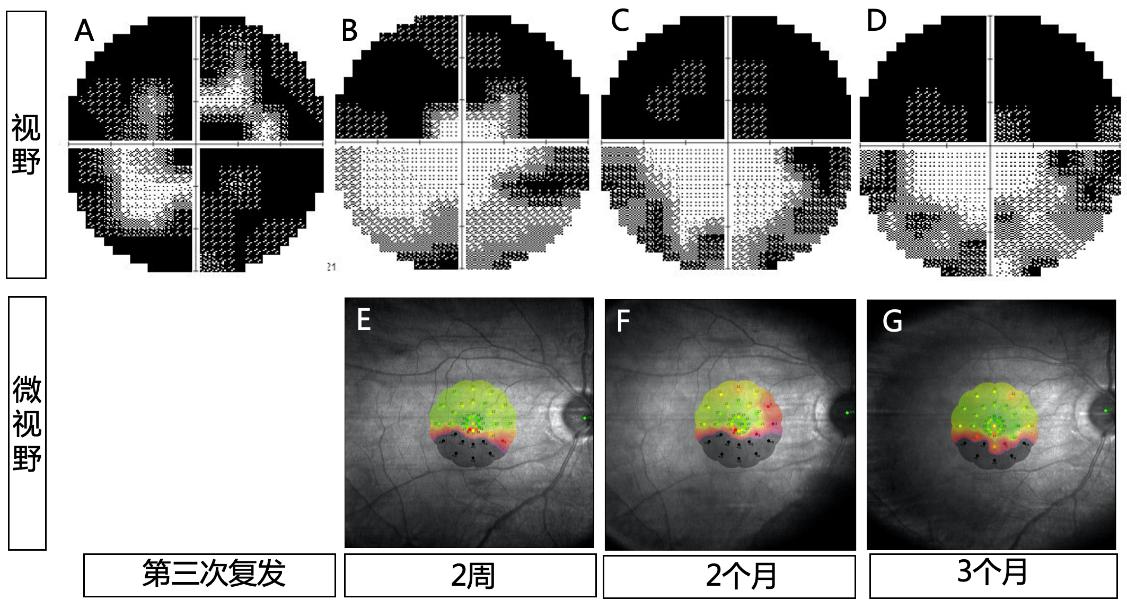
1. Papp V, Magyari M, Aktas O, et al. Worldwide incidence and prevalence of neuromyelitis optica: a systematic review[J]. Neurology, 2021, 96(2): 59-77. DOI: 10.1212/WNL.0000000000011153.
2. Hor JY, Asgari N, Nakashima I, et al. Epidemiology of neuromyelitis optica spectrum disorder and its prevalence and incidence worldwide[J]. Front Neurol, 2020, 11: 501. DOI: 10.3389/fneur.2020.00501.
3. Palace J, Lin DY, Zeng D, et al. Outcome prediction models in AQP4-IgG positive neuromyelitis optica spectrum disorders[J]. Brain, 2019, 142(5): 1310-1323. DOI: 10.1093/brain/awz054.
4. Frampton JE. Eculizumab: a review in neuromyelitis optica spectrum disorder[J]. Drugs, 2020, 80(7): 719-727. DOI: 10.1007/s40265-020-01297-w.
5. Nie T, Blair HA. Inebilizumab: a review in neuromyelitis optica spectrum disorder[J]. CNS Drugs, 2022, 36(10): 1133-1141. DOI: 10.1007/s40263-022-00949-7.
6. Cree BAC, Bennett JL, Kim HJ, et al. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a double-blind, randomised placebo-controlled phase 2/3 trial[J]. Lancet, 2019, 394(10206): 1352-1363. DOI: 10.1016/S0140-6736(19)31817-3.
7. Yamamura T, Kleiter I, Fujihara K, et al. Trial of satralizumab in neuromyelitis optica spectrum disorder[J]. N Engl J Med, 2019, 381(22): 2114-2124. DOI: 10.1056/NEJMoa1901747.
8. Traboulsee A, Greenberg BM, Bennett JL, et al. Safety and efficacy of satralizumab monotherapy in neuromyelitis optica spectrum disorder: a randomised, double-blind, multicentre, placebo-controlled phase 3 trial[J]. Lancet Neurol, 2020, 19(5): 402-412. DOI: 10.1016/S1474-4422(20)30078-8.
9. Jarius S, Wildemann B. Aquaporin-4 antibodies (NMO-IgG) as a serological marker of neuromyelitis optica: a critical review of the literature[J]. Brain Pathol, 2013, 23(6): 661-683. DOI: 10.1111/bpa.12084.
10. Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis[J]. Lancet, 2004, 364(9451): 2106-2112. DOI: 10.1016/S0140-6736(04)17551-X.
11. Lennon VA, Kryzer TJ, Pittock SJ, et al. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel[J]. J Exp Med, 2005, 202(4): 473-477. DOI: 10.1084/jem.20050304.
12. Wingerchuk DM, Hogancamp WF, O’Brien PC, et al. The clinical course of neuromyelitis optica (Devic’s syndrome)[J]. Neurology, 1999, 53(5): 1107-1114. DOI: 10.1212/wnl.53.5.1107.
13. Carnero Contentti E, Rojas JI, Cristiano E, et al. Latin American consensus recommendations for management and treatment of neuromyelitis optica spectrum disorders in clinical practice [Mult Scler Relat Disord. 2020 Oct;45: 102428[J]. Mult Scler Relat Disord, 2021, 52: 103026. DOI: 10.1016/j.msard.2021.103026.
14. Kleiter I, Gahlen A, Borisow N, et al. Apheresis therapies for NMOSD attacks: a retrospective study of 207 therapeutic interventions[J]. Neurol Neuroimmunol Neuroinflamm, 2018, 5(6): e504. DOI: 10.1212/NXI.0000000000000504.
15. Montcuquet A, Collongues N, Papeix C, et al. Effectiveness of mycophenolate mofetil as first-line therapy in AQP4-IgG, MOG-IgG, and seronegative neuromyelitis optica spectrum disorders[J]. Mult Scler, 2017, 23(10): 1377-1384. DOI: 10.1177/1352458516678474.
16. Huh SY, Kim SH, Hyun JW, et al. Mycophenolate mofetil in the treatment of neuromyelitis optica spectrum disorder[J]. JAMA Neurol, 2014, 71(11): 1372-1378. DOI: 10.1001/jamaneurol.2014.2057.
17. Mealy MA, Wingerchuk DM, Palace J, et al. Comparison of relapse and treatment failure rates among patients with neuromyelitis optica: multicenter study of treatment efficacy[J]. JAMA Neurol, 2014, 71(3): 324-330. DOI: 10.1001/jamaneurol.2013.5699.
18. Jacob A, Matiello M, Weinshenker BG, et al. Treatment of neuromyelitis optica with mycophenolate mofetil: retrospective analysis of 24 patients[J]. Arch Neurol, 2009, 66(9): 1128-1133. DOI: 10.1001/archneurol.2009.175.
19. Costanzi C, Matiello M, Lucchinetti CF, et al. Azathioprine: tolerability, efficacy, and predictors of benefit in neuromyelitis optica[J]. Neurology, 2011, 77(7): 659-666. DOI: 10.1212/WNL.0b013e31822a2780.
20. Bichuetti DB, Lobato de Oliveira EM, Oliveira DM, et al. Neuromyelitis optica treatment: analysis of 36 patients[J]. Arch Neurol, 2010, 67(9): 1131-1136. DOI: 10.1001/archneurol.2010.203.
21. Cree BAC, Kim HJ, Weinshenker BG, et al. Safety and efficacy of inebilizumab for the treatment of neuromyelitis optica spectrum disorder: end-of-study results from the open-label period of the N-MOmentum trial[J]. Lancet Neurol, 2024, 23(6): 588-602. DOI: 10.1016/S1474-4422(24)00077-2.
22. Kleiter I, Traboulsee A, Palace J, et al. Long-term efficacy of satralizumab in AQP4-IgG-seropositive neuromyelitis optica spectrum disorder from SAkuraSky and SAkuraStar[J]. Neurol Neuroimmunol Neuroinflamm, 2023, 10(1): e200071. DOI: 10.1212/NXI.0000000000200071.
23. Paul F, Marignier R, Palace J, et al. International Delphi consensus on the management of AQP4-IgG+ NMOSD: recommendations for eculizumab, inebilizumab, and satralizumab[J]. Neurol Neuroimmunol Neuroinflamm, 2023, 10(4): e200124. DOI: 10.1212/NXI.0000000000200124.
24. Papadopoulos MC, Bennett JL, Verkman AS. Treatment of neuromyelitis optica: state-of-the-art and emerging therapies[J]. Nat Rev Neurol, 2014, 10(9): 493-506. DOI: 10.1038/nrneurol.2014.141.
25. Watanabe S, Nakashima I, Misu T, et al. Therapeutic efficacy of plasma exchange in NMO-IgG-positive patients with neuromyelitis optica[J]. Mult Scler, 2007, 13(1): 128-132. DOI: 10.1177/1352458506071174.
26. Merle H, Olindo S, Jeannin S, et al. Treatment of optic neuritis by plasma exchange (add-on) in neuromyelitis optica[J]. Arch Ophthalmol, 2012, 130(7): 858-862. DOI: 10.1001/archophthalmol.2012.1126.
27. Wang L, Liu K, Tan X, et al. Remedial effect of intravenous cyclophosphamide in corticosteroid-refractory patients in the acute phase of neuromyelitis optica spectrum disorder-related optic neuritis[J]. Front Neurol, 2020, 11: 612097. DOI: 10.3389/fneur.2020.612097.
28. Collongues N, Ayme-Dietrich E, Monassier L, et al. Pharmacotherapy for neuromyelitis optica spectrum disorders: current management and future options[J]. Drugs, 2019, 79(2): 125-142. DOI: 10.1007/s40265-018-1039-7.
29. Selmaj K, Selmaj I. Novel emerging treatments for NMOSD[J]. Neurol Neurochir Pol, 2019, 53(5): 317-326. DOI: 10.5603/PJNNS.a2019.0049.
30. Jarius S, Aktas O, Ayzenberg I, et al. Update on the diagnosis and treatment of neuromyelits optica spectrum disorders (NMOSD) - revised recommendations of the Neuromyelitis Optica Study Group (NEMOS). Part I: Diagnosis and differential diagnosis[J]. J Neurol, 2023, 270(7): 3341-3368. DOI: 10.1007/s00415-023-11634-0.
31. Sellner J, Boggild M, Clanet M, et al. EFNS guidelines on diagnosis and management of neuromyelitis optica[J]. Eur J Neurol, 2010, 17(8): 1019-1032. DOI: 10.1111/j.1468-1331.2010.03066.x.
32. Xu Y, Wang Q, Ren HT, et al. Comparison of efficacy and tolerability of azathioprine, mycophenolate mofetil, and cyclophosphamide among patients with neuromyelitis optica spectrum disorder: a prospective cohort study[J]. J Neurol Sci, 2016, 370: 224-228. DOI: 10.1016/j.jns.2016.09.035.
33. Elsone L, Panicker J, Mutch K, et al. Role of intravenous immunoglobulin in the treatment of acute relapses of neuromyelitis optica: experience in 10 patients[J]. Mult Scler, 2014, 20(4): 501-504. DOI: 10.1177/1352458513495938.
34. Altunrende B, Akdal G, Bajin MS, et al. Intravenous immunoglobulin treatment for recurrent optic neuritis[J]. Noro Psikiyatr Ars, 2019, 56(1): 3-6. DOI: 10.5152/npa.2017.20577.
35. Bienia B, Balabanov R. Immunotherapy of neuromyelitis optica[J]. Autoimmune Dis, 2013, 2013: 741490. DOI: 10.1155/2013/741490.
36. Kleiter I, Gold R. Present and future therapies in neuromyelitis optica spectrum disorders[J]. Neurotherapeutics, 2016, 13(1): 70-83. DOI: 10.1007/s13311-015-0400-8.
37. Collongues N, de Seze J. An update on the evidence for the efficacy and safety of rituximab in the management of neuromyelitis optica[J]. Ther Adv Neurol Disord, 2016, 9(3): 180-188. DOI: 10.1177/1756285616632653.
38. Fragoso YD, Sousa NAC, Alves-Leon SV, et al. Clinical characteristics of 153 Brazilian patients with neuromyelitis optica spectrum disorder (NMOSD)[J]. Mult Scler Relat Disord, 2019, 27: 392-396. DOI: 10.1016/j.msard.2018.11.031.
39. Kuitwaard K, van Doorn PA. Newer therapeutic options for chronic inflammatory demyelinating polyradiculoneuropathy[J]. Drugs, 2009, 69(8): 987-1001. DOI: 10.2165/00003495-200969080-00004.
40. Cabre P, Olindo S, Marignier R, et al. Efficacy of mitoxantrone in neuromyelitis optica spectrum: clinical and neuroradiological study[J]. J Neurol Neurosurg Psychiatry, 2013, 84(5): 511-516. DOI: 10.1136/jnnp-2012-303121.
41. Yaguchi H, Sakushima K, Takahashi I, et al. Efficacy of intravenous cyclophosphamide therapy for neuromyelitis optica spectrum disorder[J]. Intern Med, 2013, 52(9): 969-972. DOI: 10.2169/internalmedicine.52.7885.
42. Kageyama T, Komori M, Miyamoto K, et al. Combination of cyclosporine A with corticosteroids is effective for the treatment of neuromyelitis optica[J]. J Neurol, 2013, 260(2): 627-634. DOI: 10.1007/s00415-012-6692-2.
43. Tahara M, Oeda T, Okada K, et al. Safety and efficacy of rituximab in neuromyelitis optica spectrum disorders (RIN-1 study): a multicentre, randomised, double-blind, placebo-controlled trial[J]. Lancet Neurol, 2020, 19(4): 298-306. DOI: 10.1016/S1474-4422(20)30066-1.
44. Gao F, Chai B, Gu C, et al. Effectiveness of rituximab in neuromyelitis optica: a meta-analysis[J]. BMC Neurol, 2019, 19(1): 36. DOI: 10.1186/s12883-019-1261-2.
45. Jeong IH, Park B, Kim SH, et al. Comparative analysis of treatment outcomes in patients with neuromyelitis optica spectrum disorder using multifaceted endpoints[J]. Mult Scler, 2016, 22(3): 329-339. DOI: 10.1177/1352458515587752.
46. Chen D, Gallagher S, Monson NL, et al. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: insights from preclinical studies[J]. J Clin Med, 2016, 5(12): 107. DOI: 10.3390/jcm5120107.
47. Frampton JE. Inebilizumab: first approval[J]. Drugs, 2020, 80(12): 1259-1264. DOI: 10.1007/s40265-020-01370-4.
48. Tanaka T, Narazaki M, Kishimoto T. Therapeutic targeting of the interleukin-6 receptor[J]. Annu Rev Pharmacol Toxicol, 2012, 52: 199-219. DOI: 10.1146/annurev-pharmtox-010611-134715.
49. Ringelstein M, Ayzenberg I, Harmel J, et al. Long-term therapy with interleukin 6 receptor blockade in highly active neuromyelitis optica spectrum disorder[J]. JAMA Neurol, 2015, 72(7): 756-763. DOI: 10.1001/jamaneurol.2015.0533.
50. Zhang C, Zhang M, Qiu W, et al. Safety and efficacy of tocilizumab versus azathioprine in highly relapsing neuromyelitis optica spectrum disorder (TANGO): an open-label, multicentre, randomised, phase 2 trial[J]. Lancet Neurol, 2020, 19(5): 391-401. DOI: 10.1016/S1474-4422(20)30070-3.
51. Yao X, Verkman AS. Complement regulator CD59 prevents peripheral organ injury in rats made seropositive for neuromyelitis optica immunoglobulin G[J]. Acta Neuropathol Commun, 2017, 5(1): 57. DOI: 10.1186/s40478-017-0462-4.
52. Pittock SJ, Lennon VA, McKeon A, et al. Eculizumab in AQP4-IgG-positive relapsing neuromyelitis optica spectrum disorders: an open-label pilot study[J]. Lancet Neurol, 2013, 12(6): 554-562. DOI: 10.1016/S1474-4422(13)70076-0.
53. Pittock SJ, Berthele A, Fujihara K, et al. Eculizumab in aquaporin-4-positive neuromyelitis optica spectrum disorder[J]. N Engl J Med, 2019, 381(7): 614-625. DOI: 10.1056/NEJMoa1900866.
54. Chan KH, Lee CY. Treatment of neuromyelitis optica spectrum disorders[J]. Int J Mol Sci, 2021, 22(16): 8638. DOI: 10.3390/ijms22168638.
55. Traub J, Husseini L, Weber MS. B cells and antibodies as targets of therapeutic intervention in neuromyelitis optica spectrum disorders[J]. Pharmaceuticals (Basel), 2021, 14(1): 37. DOI: 10.3390/ph14010037.
56. Alexopoulos H, Biba A, Dalakas MC. Anti-B-cell therapies in autoimmune neurological diseases: rationale and efficacy trials[J]. Neurotherapeutics, 2016, 13(1): 20-33. DOI: 10.1007/s13311-015-0402-6.
57. Tradtrantip L, Duan T, Yeaman MR, et al. CD55 upregulation in astrocytes by statins as potential therapy for AQP4-IgG seropositive neuromyelitis optica[J]. J Neuroinflammation, 2019, 16(1): 57. DOI: 10.1186/s12974-019-1448-x.
58. Tradtrantip L, Zhang H, Saadoun S, et al. Anti-aquaporin-4 monoclonal antibody blocker therapy for neuromyelitis optica[J]. Ann Neurol, 2012, 71(3): 314-322. DOI: 10.1002/ana.22657.