蛋白 A 免疫吸附治疗MOG抗体相关视力障碍的临床研究
关键词
摘要
全文
文章亮点
1. 关键发现
• 本研究显示蛋白 A 免疫吸附联合糖皮质激素治疗 MOG-ON 效果良好。治疗后 6 个月,6/7 例患者视力较治疗前改善,其中 4/7 例视力改善显著,左眼 LogMAR 视力值从 0.20(0.14, 0.70) 改善至 0.10(0.10, 0.42),右眼从 0.30(0.19, 0.47) 改善至 0.18(0.10, 0.21),EDSS 视力评分从 2.86±1.68 降至 1.43±1.51(P<0.05)。同时 MOG 抗体滴度从治疗前几何平均数1:52.0(GSD=3.36) 显著降至治疗后 6 个月 1:13.0(GSD=3.7)(P=0.027),其中 4/7 例患者血清抗体转阴,2/7 例滴度降低。值得关注的是,1 例双眼无光感的重症患者经治疗后恢复至 LogMAR: OD 0.54,OS 0.7。35 次治疗过程中未观察到严重不良反应。2. 已知与发现
• MOG-ON 作为 MOGAD 主要临床表现,常导致严重视力障碍,目前治疗主要依赖大剂量激素、IVIG 及血浆置换,但缺乏统一治疗标准。本研究在国内首次探索了蛋白 A 免疫吸附联合糖皮质激素治疗 MOG-ON 的可行性,发现即使病程长达 150 天的患者仍可获得视力改善,为错过早期治疗时机的患者提供了新的治疗思路。研究还观察到治疗 3 个月至 6 个月期间 4/7 例患者视力仍有进一步改善,提示可能存在延迟修复机制,本研究采用的隔天 1 次、共 5 次治疗方案显示出良好的耐受性和可操作性。3. 意义与改变
• 这项研究为 MOG-ON 患者提供了新的治疗选择,特别对激素治疗反应欠佳的患者具有重要参考价值,治疗策略从单纯症状控制转向针对性清除致病抗体,相比传统血浆置换具有更好的选择性。研究为眼科与神经科协作治疗提供了初步经验,抗体滴度的动态监测有助于评估疗效和预测复发风险 (1 例复发患者抗体持续阳性 )。本研究为国内 MOG-ON 免疫吸附治疗积累了宝贵经验,虽然样本量有限,但为后续更大规模临床研究提供了重要数据支持,有助于推进 MOGAD 治疗方案的进一步规范化探索。自1986年Lebar等首次发现髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)以来,对MOG抗体相关疾病(MOG antibody-associated disease,MOGAD)的认识不断深入,发病机制主要与循环中的MOG-IgG抗体通过结合位于少突胶质细胞表面的MOG蛋白,激活补体系统,进而引起髓鞘损伤和炎症反应密切相关[1-2]。视神经炎作为MOGAD的主要临床表现之一,常导致严重的视力障碍,甚至可能造成永久性视力损害,严重影响患者生活质量[3]。然而,目前MOG抗体相关视神经炎(MOG antibody-associated optic neuritis, MOG-ON)的临床治疗仍面临诸多挑战,尤其是对于糖皮质激素(激素)治疗效果不佳或存在激素禁忌证的患者,亟需探索更为有效的治疗方案。
当前,MOG-ON的治疗尚无统一标准,对急性期患者主要采用大剂量激素、静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)及血浆置换或免疫吸附治疗[4-5]。蛋白A免疫吸附是一种选择性清除自身抗体的治疗方法,通过特异性吸附血浆中IgG类抗体,同时保留其他血浆成分[6]。蛋白A是金黄色葡萄球菌细胞壁提取物,可特异性结合人IgG的Fc片段,尤其对IgG1、IgG2和IgG4亚型具有高亲和力[7]。蛋白A与IgG的结合是可逆的,在酸性环境(pH 2.2)下可解离,这使得蛋白A免疫吸附柱可以反复再生使用。由于MOG抗体主要为IgG1亚型,理论上蛋白A免疫吸附可高效清除MOG抗体,减轻其对视神经的免疫介导损伤[8]。
然而,目前关于蛋白A免疫吸附联合激素治疗MOG-ON的临床数据有限,本研究旨在探讨该疗法对MOG-ON的临床疗效及安全性。
1 资料与方法
1.1 一般资料
回顾性分析2022年6月—2024年12月在广东三九脑科医院神经内科确诊并接受蛋白A免疫吸附治疗的7例MOG-ON患者的临床资料。纳入标准:1)符合2020年《抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体相关疾病诊断和治疗中国专家共识》及2023年国际MOGAD专家组(International MOGAD Panel)提出的诊断标准[9-10];2)血清和(或)脑脊液MOG抗体阳性:所有患者均进行血清MOG抗体检测,脑脊液MOG抗体检测在获得腰椎穿刺标本的患者中进行;3)存在MOG-ON相关视力障碍;4)接受蛋白A免疫吸附联合激素治疗;5)随访资料完整,随访时间≥6个月。排除标准:1)存在其他可导致视力下降的眼部疾病,如白内障、青光眼等;2)合并其他中枢神经系统感染或肿瘤;3)蛋白A免疫吸附治疗禁忌证:如严重凝血功能异常、活动性出血、严重心脑血管疾病等;4)排除多发性硬化(multiple sclerosis,MS)、视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)等其他中枢神经系统脱髓鞘疾病,所有病例经2位经验丰富的神经科专家独立评估确认;5)临床资料不完整。本研究已获得医院伦理委员会批准(批件号:伦审字2023-01-021)。1.2 研究方法
1.2.1 临床资料收集收集患者的一般资料、既往史、临床症状、实验室检查、视力评估、影像学检查[脑和视神经磁共振成像(magnetic resonance imaging,MRI)]等资料。记录治疗前后扩展残疾状态量表(Expanded Disability Status Scale, EDSS)评分[11]、视力评分以及MOG抗体滴度变化、治疗相关不良反应。
1.2.2 视力评估
采用LogMAR视力表评估患者的最佳矫正视力(best corrected visual acuity,BCVA),并根据EDSS量表中视力系统评分标准进行评分:0分为正常;1分为有视野缺损但矫正视力优于20/30;2分为较差眼有视野缺损且最佳矫正视力在20/30~20/59;3分为较差眼有大范围视野缺损或视野中度减少,但最佳矫正视力在20/60~20/99;4分为较差眼视野明显减少且最佳矫正视力在20/100~20/200,或3级视力损害且较好眼最佳矫正视力为20/60或更差;5分为较差眼最佳矫正视力低于20/200,或4级视力损害且较好眼最佳矫正视力为20/60或更差;6分为5级视力损害且较好眼最佳矫正视力为20/60或更差。
1.2.3 实验室检查
MOG抗体检测采用基于细胞的检测方法(cell-based assay,CBA),将滴度≥1:10者判定为阳性,所有患者均完成治疗前、治疗后3个月和治疗后6个月血清MOG抗体检测,所有患者均完成治疗前脑脊液MOG抗体检测,仅1例患者在疾病复发时完成了脑脊液MOG抗体复查。治疗前所有患者均检测脑脊液常规、生化及自身免疫抗体,包括髓鞘少突胶质细胞糖蛋白抗体(myelin oligodendrocyte glycoprotein antibody,MOG抗体)、水通道蛋白4抗体(aquaporin-4 antibody,AQP4抗体)、N-甲基-D-天冬氨酸受体抗体(N-methyl-D-aspartate receptor antibody,NMDAR抗体)、胶质纤维酸性蛋白抗体(glial fibrillary acidic protein antibody,GFAP抗体)等。
1.2.4 影像学检查
所有患者均进行脑MRI平扫及增强扫描和眼眶MRI检查,部分患者行全脊髓MRI检查。视觉诱发电位(visual evoked potential,VEP)检查用于评估视传导功能。
1.2.5 治疗方案选择
所有患者均接受蛋白A免疫吸附联合激素治疗,治疗方案选择基于临床医生综合评估患者病情严重程度、治疗反应、合并症等因素及患者知情同意后决定。本研究为回顾性分析,未预设统一的治疗选择标准。
1.2.6 免疫吸附治疗方案
免疫吸附采用广州康盛生物科技有限公司生产的KCIA08型号的蛋白A吸附柱,以及旭化成医疗株式会社(日本)膜型血浆分离器(OP-08W),该系统利用金黄色葡萄球菌蛋白A与人IgG抗体Fc段的特异性结合原理,选择性清除血液中的IgG抗体(包括MOG-IgG)。治疗流程遵循《中国神经免疫病免疫吸附治疗临床应用指南(2022)》[3]:1)建立血管通路,一般选择颈内静脉或股静脉;2)抗凝,予普通肝素钠,一般首剂量0.5~1.0 mg/kg,追加剂量10~20 mg/h,间歇性静脉注射或持续性静脉输注,预期结束前30 min停止追加,肝素剂量依据患者的凝血状态个体化调整;3)血浆分离,使用膜型血浆分离器,血流速度控制在80~140 mL/min;4)免疫吸附,血浆通过蛋白A吸附柱,每个患者单次处理2.0~2.5倍血浆量(血浆量=0.065 ×体质量×(1-血细胞比容),约2 000~3 000 mL),当吸附柱达到饱和状态时进行酸碱再生;5)完成治疗后反输全部血细胞及处理后的血浆。治疗全程持续监测患者血压、心率及血氧饱和度。单次治疗时长控制在4~6 h(不超过8 h),隔天1次,共5次为1个疗程。若患者出现低血压[收缩压<90 mmHg(1 mmHg=0.133 kPa)],立即暂停治疗并静脉输注生理盐水(500 mL/15 min)。所有患者均接受蛋白A免疫吸附治疗联合激素治疗,激素治疗采用标准化方案:甲泼尼龙1 000 mg/d静脉滴注治疗连续3 d,随后采用“3-3-3-3递减方案”(即每3 d将前一阶段剂量减半,每阶段维持3 d),最终减至甲泼尼龙4 mg/d口服维持治疗。对于病情复发或MOG抗体持续阳性(滴度≥1:32)的患者,联合使用免疫抑制剂治疗(吗替麦考酚酯每日2次口服,根据患者体重及病情严重程度个体化选择500 mg或750 mg剂量,维持治疗12~24个月,根据抗体转阴情况和临床缓解程度调整疗程)。
1.3 随访及疗效评价
于患者治疗前及治疗后随访第3、6个月,评估治疗效果、复发情况及不良反应。主要疗效指标:1)视力变化,比较治疗前、治疗后3个月和6个月的视力;2)EDSS视力评分变化;3)血清MOG抗体滴度变化治疗前及治疗后3个月、6个月检测MOG抗体滴度。次要疗效指标:1)总EDSS评分变化;2)复发率;3)不良反应发生情况。1.4 统计学方法
采用SPSS 26.0软件进行统计分析。鉴于样本量较小(n=7),计量资料采用Shapiro-Wilk检验评估数据分布。符合正态分布的数据(年龄、EDSS评分)以均数±标准差表示,治疗前后比较采用配对t检验;不符合正态分布的数据(logMAR视力评分)以中位数(四分位数间距)[M(P25,P75)]表示,采用Wilcoxon符号秩检验比较治疗前后差异。抗体滴度数据以几何平均滴度(geometric mean titer,GMT)及几何标准差(geometric standard deviation,GSD)表示,用于描述数据的集中趋势和离散程度;阴性结果(<1:10)赋值为检测限(1:10)的一半(即1:5)进行计算,采用Wilcoxon符号秩检验比较治疗前后差异。计数资料以构成比表示。P < 0.05为差异有统计学意义。2 结果
2.1 患者人口学特征和临床特点
本研究共纳入7例MOG-ON患者,男性3例,女性4例,年龄11~63岁,平均年龄为(39.4±15.7)岁。病程5~150 d,中位数12 d。4例患者首发症状为视力障碍,2例首发症状为头痛但同时伴有视力异常,1例首发症状为肢体麻木伴视力障碍。1例合并GFAP抗体阳性。4例有相关既往病史,分别为双向情感障碍1例、结核性脑膜炎1例、类风湿关节炎1例,以及1例既往曾有NMDAR和AQP4抗体阳性病史。颅内压升高1例,脑脊液检查示异常5例,主要表现为白细胞增多和(或)蛋白升高。寡克隆带(oligoclonal band,OCB)阳性1例。2.2 影像学及电生理检查结果
颅脑MRI表现为视神经信号异常及增强3例,皮层及皮质下白质病变2例,脑干病变3例,软脑膜病变1例。VEP异常4例,主要表现为潜伏期延长和(或)波幅降低(图1)。脑电图异常4例,主要表现为癫痫样放电或局部慢波活动。
图 1 影像学表现
Figure 1 Imaging findings
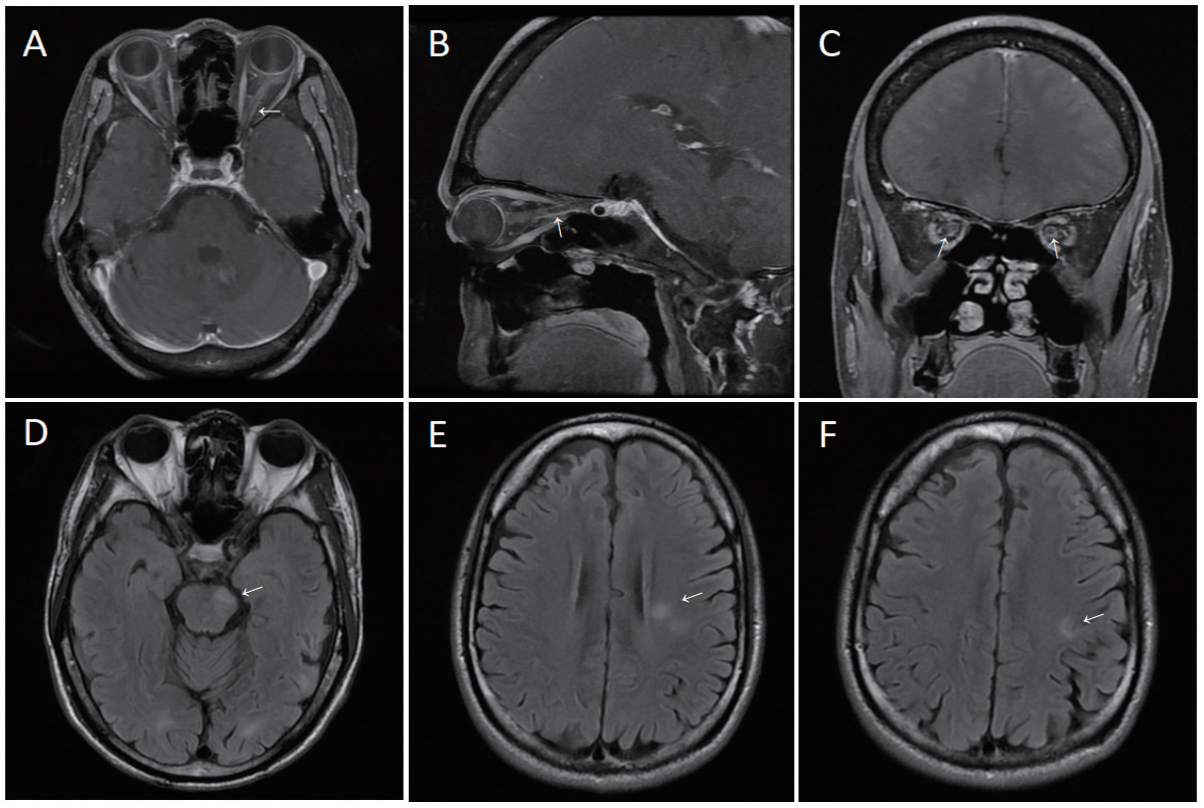
A-C demonstrate orbital T1-weighted contrast-enhanced sequences of Patient 1, revealing left optic nerve atrophy with linear contrast enhancement within the proximal segments of bilateral optic nerves (arrows); D-F show brain T2 FLAIR sequences of Patient 4, demonstrating multifocal hyperintense lesions in the left brainstem, left periventricular white matter, and centrum semiovale.
2.3 MOG抗体检测及治疗后变化
所有患者均进行了血清及脑脊液MOG抗体检测,血清MOG抗体阳性7例,脑脊液MOG抗体阳性5例,滴度范围为1∶10~1∶320(表1)。治疗前血清MOG抗体滴度几何均数为1:52.0(GSD=3.7),治疗后3个月降至1:8.8(GSD=1.9)(P=0.027),治疗后6个月进一步降至1:13.0(GSD=4.1)(P=0.027)。治疗后3~6个月期间,抗体滴度仍呈下降趋势,但差异未达统计学意义(P=0.285)(表2)。7例患者中,4例转阴,2例滴度降低,1例无明显变化。
表 1 患者临床症状、视力及治疗前后 MOG 抗体滴度变化
Table 1 Clinical symptoms, visual acuity and changes of MOG antibody titers before and after treatment
|
序号 |
性别 |
年龄 |
首发症状 |
病史及 合并抗体 |
治疗前LogMAR视力值 |
治疗后MOG抗体滴度 |
||||
|
|
|
3个月 |
6个月 |
|||||||
|
左 |
右 |
血清 |
脑脊液 |
血清 |
血清 |
|||||
|
1 |
女 |
52 |
视力障碍 |
双相情感障碍病史 |
0.7 |
0.4 |
1:100 |
0 |
1:10 |
1:100 |
|
2 |
女 |
32 |
视力障碍 |
无 |
0.7 |
0.54 |
1:100 |
0 |
0 |
0 |
|
3 |
男 |
35 |
视力障碍 |
无 |
3 |
3 |
1:10 |
1:320 |
1:10 |
0 |
|
4 |
男 |
41 |
头痛 |
结核性脑膜炎病史 |
0.18 |
0.18 |
1:320 |
1:32 |
1:32 |
1:100 |
|
5 |
女 |
63 |
肢体麻木 |
合并GFAP抗体阳性 类风湿关节炎病史 |
0.1 |
0.1 |
1:10 |
1:10 |
0 |
0 |
|
6 |
男 |
42 |
头痛 |
NMDA和AQP4抗体阳性病史 |
0.1 |
0.18 |
1:32 |
1:32 |
0 |
0 |
|
7 |
女 |
11 |
视力障碍 |
无 |
0.18 |
0.3 |
1:100 |
1:10 |
1:10 |
1:10 |
年龄单位为岁;0表示MOG抗体阴性;患者4为本研究期间唯一复发者,治疗后6个月抗体滴度仍高。LogMAR视力值保持原始测量记录的精度,小数位数反映实际测量精确度。
Age is expressed in years; 0 indicates MOG antibody negative; Patient 4 was the only one who relapsed during the study period, with persistently high antibody titers at 6 months after treatment. LogMAR visual acuity values maintain the precision of original measurements, with decimal places reflecting actual measurement accuracy.
表 2 治疗前后 MOG 抗体滴度
Table 2 MOG antibody titers before and after treatment
2.4 视力及EDSS评分改善情况
大部分患者在抗体滴度下降的同时,视力亦有不同程度改善。治疗前,患者左眼视力中位数为0.20(0.14,0.70),右眼视力中位数为0.30(0.19,0.47),EDSS视力评分为2.86±1.68,总EDSS评分为3.86±2.40,其中患者3初始表现为双眼无光感,EDSS视力评分为6分。治疗后3个月,左眼LogMAR视力值改善至0.18(0.10,0.47),右眼LogMAR视力值改善至0.18(0.10,0.24),EDSS视力评分降至1.57±1.51,总EDSS评分降至2.57±1.72,差异均有统计学意义(P<0.05)。治疗后6个月,左眼LogMAR视力值进一步改善至0.10(0.10,0.42),右眼LogMAR视力值为0.18(0.10,0.21),EDSS视力评分降至1.43±1.51,总EDSS评分降至2.43±1.81,与治疗前比较差异均有统计学意义(P<0.05),见表3。
表 3 治疗前后视力及 EDSS 评分变化 (n=7)
Table 3 Changes in visual acuity and EDSS scores before and after treatment (n=7)
符合正态分布数据以均数±标准差表示,采用配对t检验;非正态分布数据以中位数(四分位数间距)表示,采用Wilcoxon符号秩检验。P<0.05为差异有统计学意义。
Normally distributed data are presented as mean ± standard deviation and compared using paired t-test; non-normally distributed data are presented as median (interquartile range) and compared using Wilcoxon signed-rank test. P<0.05 was considered statistically significant.
2.5 随访及复发情况
治疗后6个月,7例患者视力较治疗前不同程度改善,其中4/7例患者视力改善明显(LogMAR值下降≥0.3),其中1例患者由无光感恢复至BCVA(LogMAR): OD 0.54, OS 0.7。治疗3~6个月期间,4/7例患者视力仍有进一步改善。6个月随访期内,1例患者(病例4)出现复发,发生在治疗后第6个月,表现为头痛、发热,复发时检测该患者血清MOG抗体1:100,脑脊液MOG抗体1:10,复发后接受了甲泼尼龙静脉冲击递减与口服免疫抑制剂维持治疗,头痛、发热好转,但视力未见明显改善。该患者正是表1中6个月随访时抗体滴度未下降的患者之一。2.6 安全性评价
7例患者共接受35次免疫吸附治疗,未观察到严重不良反应。2例患者在治疗过程中出现一过性低血压,经减慢血流速度和补充生理盐水后缓解;1例患者出现一过性头晕,未予特殊处理,自行缓解;无患者出现严重出血、过敏反应或感染等不良事件。3 讨论
MOGAD是一类以中枢神经系统脱髓鞘为特征的自身免疫性疾病,视力障碍作为MOGAD的常见表现,往往严重影响患者的生活质量,且若不及时干预可能导致永久性视力损害[9]。根据2023年国际MOGAD专家小组制定的诊断标准[9],MOG-ON与其他类型的视神经炎在临床表现、影像学特点和预后方面存在明显差异。本研究中4/7例患者以视力障碍为首发症状,这与既往文献报道MOGAD患者中视神经炎高发的特点相符[12]。值得注意的是,本研究中一例患者合并GFAP抗体阳性,一例患者曾有NMDAR和AQP4抗体阳性病史,这提示MOGAD可能与其他自身免疫性疾病共存,增加了诊断和治疗的复杂性。在MOGAD中,MOG-IgG作为致病抗体,通过结合位于少突胶质细胞表面的MOG蛋白,激活补体,引起髓鞘损伤和炎症反应[2]。因此,清除循环中的MOG-IgG对阻断疾病进程至关重要。本研究结果表明蛋白A免疫吸附联合激素治疗对MOG-ON具有显著疗效和良好的安全性。本研究观察到,在大多数患者中,抗体滴度随治疗下降的同时,视力呈现改善趋势,提示抗体水平降低可能有助于改善视力,但相关性有待进一步研究。这种延迟性改善可能与多种因素有关:一方面是炎症消退后的神经组织修复过程需要时间;另一方面,免疫吸附治疗联合激素及免疫抑制剂可能共同作用于免疫调节网络,产生长期的免疫重构效应[13-14]。
本研究中,尽管整体患者MOG抗体滴度在治疗后呈下降趋势,但仍观察到个体间的差异。患者4在随访过程中出现复发,其抗体滴度持续阳性,提示抗体滴度的动态变化可能与复发风险相关,这与既往研究报道的MOGAD复发风险相符[12]。这种个体差异可能与患者的免疫反应、疾病活动性或基础临床特征相关。对于此类滴度未降或升高的患者,应加强长期随访,并根据个体需要调整免疫治疗方案。未来需进一步研究MOG抗体滴度变化与复发的预测价值,以优化个体化管理策略。
值得注意的是,一例初始表现为双眼无光感的患者在治疗后恢复至BCVA(LogMAR): OD 0.54、 OS 0.7,这表明即使是严重的视力障碍患者也可能从蛋白A免疫吸附联合激素治疗中获益。另本研究发现病程150 d的患者,在接受蛋白A免疫吸附治疗后仍有视力改善,这与既往认为MOGAD具有较好修复潜能的观点一致[15],同时也为错过最佳治疗窗口期的患者提供了新的治疗希望。
MOG-ON与AQP4抗体相关视神经炎具有不同的临床特征和预后。MOG-ON主要侵犯前部视神经,常表现为视盘水肿,且常累及双眼[3]。本研究中4/7患者VEP检查显示异常,反映了视觉传导通路受损。既往研究表明,MOG-ON虽然短期内症状可能较为严重,但总体预后相对较好[16],与本研究观察到的显著视力改善结果一致。本研究中多数患者获得了良好的视力恢复,这提示早期干预可能避免不可逆的轴突损伤。
蛋白A免疫吸附在MOG-ON患者中具有良好的耐受性。与血浆置换相比,蛋白A免疫吸附更为选择性地清除致病抗体,同时保留血浆中的其他重要成分,如凝血因子、白蛋白等[7, 17],这可能是本研究中未观察到严重不良反应的原因之一。相较于IVIG,蛋白A免疫吸附能够更快速地清除循环抗体,对急性期视力障碍患者尤为有益[5]。本研究验证了蛋白A免疫吸附联合激素在MOG-ON治疗中的有效性,为眼科-神经科多学科协作提供了重要的循证依据。MOG-ON作为一类重要的脱髓鞘性视神经炎,尤其是在双眼受累、视力严重下降(≤0.1)、常规激素治疗效果不佳的患者建议尽早开始免疫吸附治疗[18]。
本研究的局限性在于单臂设计且样本量有限,治疗选择基于临床医生综合判断及个体选择而非统一标准。非随机性设计、缺乏对照组及患者基线特征异质性等限制了对蛋白A免疫吸附独立疗效的客观评估。此外,随访时间相对较短,未能系统进行脑脊液 MOG抗体动态监测以精确评估抗体清除效能。基于目前的样本量和随访时间,尚不能证明蛋白A吸附治疗联合激素治疗能够有效预防疾病复发。尽管存在上述局限性,本研究仍为MOG-ON的治疗提供了初步证据和临床参考。
本研究结果显示,蛋白A免疫吸附联合激素治疗能够降低MOG抗体滴度,改善部分MOG-ON患者的视力,且安全性良好。尽管存在上述局限性,本研究反映了临床实践的真实情况,为临床医生提供了初步的安全性和有效性参考。未来需开展更大样本的前瞻性对照研究,建立明确的治疗适应证和标准化方案,进一步验证长期疗效,探索最佳治疗方案及治疗时机,并深入研究其对视神经功能恢复的机制。
声明
在论文撰写中未使用生成式人工智能。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。利益冲突
所有作者均声明不存在利益冲突。开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。基金
This work was supported byGuangdong Provincial Medical Science and Technology Research Fund Project (B2024136).
参考文献
Neuroimmunology Branch of Chinese Society for Immunology. Chinese expert consensus on diagnosis and treatment of MOG-IgG associated disorders[ J]. Chin J Neuroimmunol Neurol, 2020, 27(2): 86-95. DOI: 10.3969/j.issn.1006-2963.2020.02.002.
Neuro-ophthalmology Group, Ophthalmological Society, Chinese Medical Association, Evidence-Based Medicine Center of Lanzhou University/WHO Collaborating Centre for Guideline Implementation and Knowledge Translation. Evidence-based clinical practice guideline for diagnosis and treatment of demyelinating optic neuritis in China (2021) [ J]. Chinese Journal of Ophthalmology, 2021, 57(03): 171- 186.DOI:10.3760/cma.j.cn112142-20201124-00769.