PEI联合房角分离及房角切开治疗中晚期CPACG合并白内障患者的临床观察
关键词
摘要
全文
文章亮点
1. 关键发现
• 在 6 个月的随访期间,PEI 联合房角分离及房角切开治疗中晚期 CPACG 合并白内障可有效地提高视力、降低眼压,且无严重并发症,手术安全有效。2. 已知与发现
• 针对合并白内障的中晚期 CPACG,传统的手术方式为 PEI 联合小梁切除术,而术后难以避免浅前房、低眼压、恶性青光眼等并发症及风险。近年来,PEI 联合房角分离术 (goniosynechialysis, GSL) 逐步成为治疗 CPACG 的一种新的微创青白联合手术方式,可有效解除房角粘连,加深前房,减少虹膜与小梁网的接触面积,以减少房水外流的阻力,从而更好地降低眼压。房角切开术 (goniotomy, GT) 则可在解除房角粘连的基础上进一步打开小梁网 -Schlemm 管通路,开放受阻的房水流出途径,同时沟通前房和 Schlemm 管,增加房水的内引流。目前,关于 CPACG 进展至中晚期,且小梁网功能已显著受损的患者,采用 PEI 联合 GSL 及 GT 这一手术方式的疗效研究尚不多见。3. 意义与改变
• 本研究通过回顾性分析,评估 PEI 联合 GSL 及 GT 治疗合并白内障的中晚期 CPACG 患者的临床效果,分析手术前后患者的视力及眼压等指标变化。研究发现 PEI 联合 GSL 及 GT 用于治疗中晚期 CPACG 合并白内障的手术效果良好,创伤小、对患者影响轻微,在临床上易于开展和推广,可以作为治疗中晚期 CPACG 合并白内障的首选治疗方案。原发性闭角型青光眼(primary angle-closure glaucoma,PACG)是世界范围内高发病率的致盲性眼病之一 [1-2] 。预计到2040年, PACG在全球范围的患者人数将达3 400万,其中530万患者将面临失明风险,致盲率远高于原发性开角型青光眼[3-4]。针对合并白内障的中晚期原发性慢性闭角型青光眼(chronic primary angle-closure glaucoma,CPACG),传统的手术方式为超声乳化白内障吸除人工晶状体植入术(phacoemulsification with intraocular lens implantation, PEI)联合小梁切除术,然而术后难以避免浅前房、低眼压、恶性青光眼等并发症及风险[5-6]。近年来,PEI联合房角分离术(goniosynechialysis, GSL)已逐步发展为治疗CPACG的一种重要的微创青白联合手术方式,它可以有效解除瞳孔阻滞,加深前房深度,并机械性分离房角粘连处,减少虹膜与小梁网的接触面积,以减少房水外流的阻力,从而更好地降低眼压[7-8]。而在此基础上联合实施的房角切开术(goniotomy, GT),则能进一步切开功能异常的小梁网,直接开放小梁网-Schlemm管这一核心房水流出通路,它不仅增强了房水的内引流效率,更能与PEI、GSL产生协同作用,共同构建起一条从前房至Schlemm管的通畅引流途径,从而实现更高效、持久的降眼压效果[9-10]。目前,关于CPACG进展至中晚期,且小梁网功能已显著受损的患者,采用PEI联合GSL及GT这一手术方式的疗效研究尚不多见。为此,本研究通过回顾性分析,评估上述联合术式治疗合并白内障的中晚期CPACG患者的临床效果,分析手术前后患者的视力及眼压等指标变化。
1 对象与方法
1.1 研究对象
采用回顾性研究,本研究通过成都市中西医结合医院伦理委员会审查(批件号:2024年YNYJ第034号),收集2020年6月至2024年1月在成都市中西医结合医院就诊并行PEI联合GSL及GT的中晚期CPACG合并白内障患者94例133眼的临床资料,其术前病情、相关检查及术后随访资料均被纳入评估,患者组成为男41例56眼,女53例77眼;年龄41~98(中位数71)岁 。纳入标准:1)性别、年龄不限;2)符合CPACG诊断标准[10];3)存在明显的白内障,且经临床医师评估需行PEI者;4)存在药物控制不佳的高眼压;5)患者及其家属知情同意,依从性良好,且随访时间不少于6个月,病历及检查资料完整。
排除标准:1)有眼内手术史;2)房角结构检查不清;3)合并其他类型的青光眼,如继发性闭角型青光眼、新生血管性青光眼等;4)合并严重全身系统性疾病。本研究遵循《赫尔辛基宣言》,经成都市中西医结合医院伦理委员会批准(批件号:2024年YNYJ第034号),患者及其家属已签署研究知情同意书。
1.2 手术方法
所有手术均由同一位术者完成。在颞上方透明角膜缘做2.2 mm的主切口,随后做一侧切口,连续环形撕囊后经由超声乳化技术吸除晶状体核和皮质,囊袋内植入可折叠人工晶状体。完成上述步骤后,依次进行GSL与GT操作。首先行GSL,前房内注入稀释卡巴胆碱(1﹕1)以收缩瞳孔,并注入足量黏弹剂维持前房深度,随后将显微镜镜头倾斜 45°,于角膜表面涂抹黏弹剂后放置房角镜,在房角镜直视下用黏弹剂分离周边虹膜前粘连,使房角开放范围达270°以上;继而行GT,使用Zeng's小梁切开刀(图1)经主切口进入前房,将刀头尖端插入主切口对侧的小梁网并进入 Schlemm 管,在房角镜直视引导下,沿小梁网及 Schlemm管内壁切开约120°范围(图2)。最后,彻底冲洗并吸除前房内残留的黏弹剂及可能存在的积血,并以水密方式闭合角膜切口。手术结束时,术眼涂以妥布霉素地塞米松眼膏并用无菌纱布遮盖。术后术眼的常规用药方案为:妥布霉素地塞米松滴眼液及双氯芬酸钠滴眼液,每日4次,并自术后第1周起每周递减1次,总疗程为1个月;若术后1周前房炎症反应消退稳定,则加用毛果芸香碱滴眼液,每日3次,持续使用至术后1个月。
图1 Zeng's小梁切开刀
Figure 1 Zeng’s trabeculotome
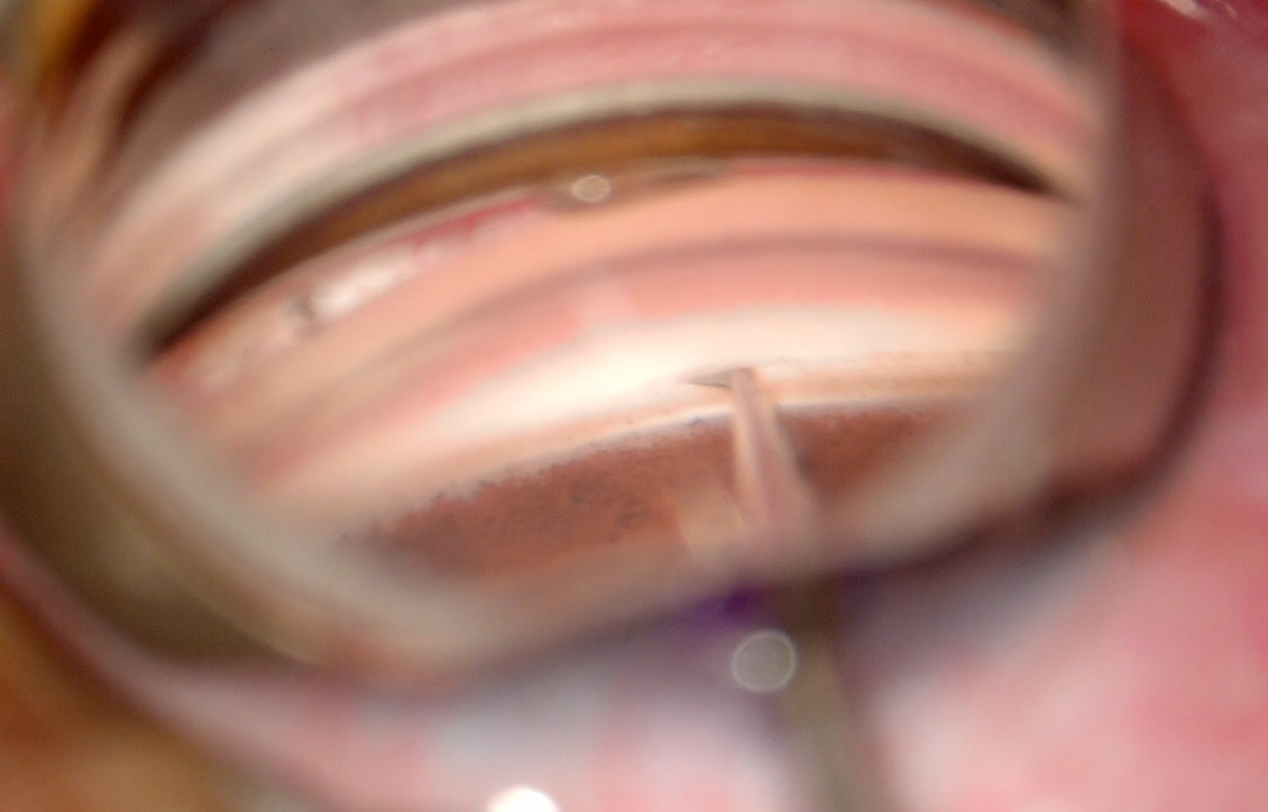
图2 在房角镜直视下分离粘连的房角
Figure 2 Separation of goniosynechiae under direct gonioscopic view
1.3 观察指标
所有患者术前均详细采集病史和抗青光眼药物使用情况,术前使用裂隙灯生物显微镜与前置镜行眼前后节段检查;使用非接触式眼压计(CT-1,日本TOPCON)测量眼压;采用国际标准对数视力表测定最佳矫正视力(记录为logMAR值);使用眼科光学生物测量仪(Optical Biometry, IOLMaster 700, 德国蔡司)测量眼轴长度并计算人工晶状体度数;使用超声生物显微镜(SW-3200L, 天津索维)评估前房深度及房角形态;使用裂隙灯生物显微镜与房角镜检查房角;使用血管成像OCT(RTVue XR,美国RPTOVUE)分析视盘神经纤维层厚度及视盘周围血管密度;使用视野分析仪(WZZ0322002417,德国蔡司)检查视野。本研究的术后随访时间点设定为术后1天、1周以及1、3、6个月,于各时间点分别采集并记录患者的视力、眼压、降眼压药物使用数量、手术并发症及再次手术情况。1.4疗效标准[11]
完全成功:术后不使用抗青光眼药物且眼压低于21 mmHg(1 mmHg=0.133 kPa)。条件成功:使用2种及以下抗青光眼药物后眼压低于21 mmHg。手术失败:术后使用2种以上抗青光眼药物时眼压仍大于21 mmHg。手术总成功率=(完全成功眼数+条件成功眼数)/总眼数×100%。眼压反跳(IOP spike)定义为术后1个月内眼压在30 mmHg以上,与峰值前相比升高10 mmHg以上,然后又降低到21 mmHg以下[12]。1.5 统计学方法
采用SPSS25.0软件进行统计分析,采用Shapiro-Wilk检验对计量资料进行正态性检验,符合正态分布的计量资料用x±s表示,采用重复测量方差分析比较手术前后各时间点的眼压差异;非正态分布数据以M(P25,P75)表示,采用Wilcoxon秩检验;P<0.05为差异有统计学意义。2 结果
2.1 一般资料
本研究共纳入行PEI联合GSL及GT治疗的中晚期CPACG合并白内障患者94例133眼,其中男40例56眼,女54例77眼;手术眼别右眼22例,左眼31例,双眼40例;年龄(70.25±9.57)岁。2.2 手术情况
本研究所纳入的94例(133眼)患者均顺利完成手术,具体手术成功率详见表1。
表1 纳入患者手术成功率(n=133)
Table 1 Surgical success rate of the enrolled patients (n=133)
|
指标 |
术后1天 |
术后1周 |
术后1个月 |
术后3个月 |
术后6个月 |
|
完全成功[眼( %)] |
104(78) |
108(81) |
109(82) |
114(86) |
121(91) |
|
条件成功[眼( %)] |
0(0) |
5(4) |
13(10) |
18(14) |
10(8) |
2.3 手术前后眼压及用药情况
纳入患者的术前平均眼压为(40.32±9.15)mmHg,相较于该基线水平,术后各时间点的平均眼压均较术前明显下降,差异具有统计学意义(F=189.79,P<0.001)。见表2及图3。
图 3 纳入患者手术前后眼压(n=133)
Figure 3 Intraocular pressure of the enrolled patients before and after surgery (n=133)
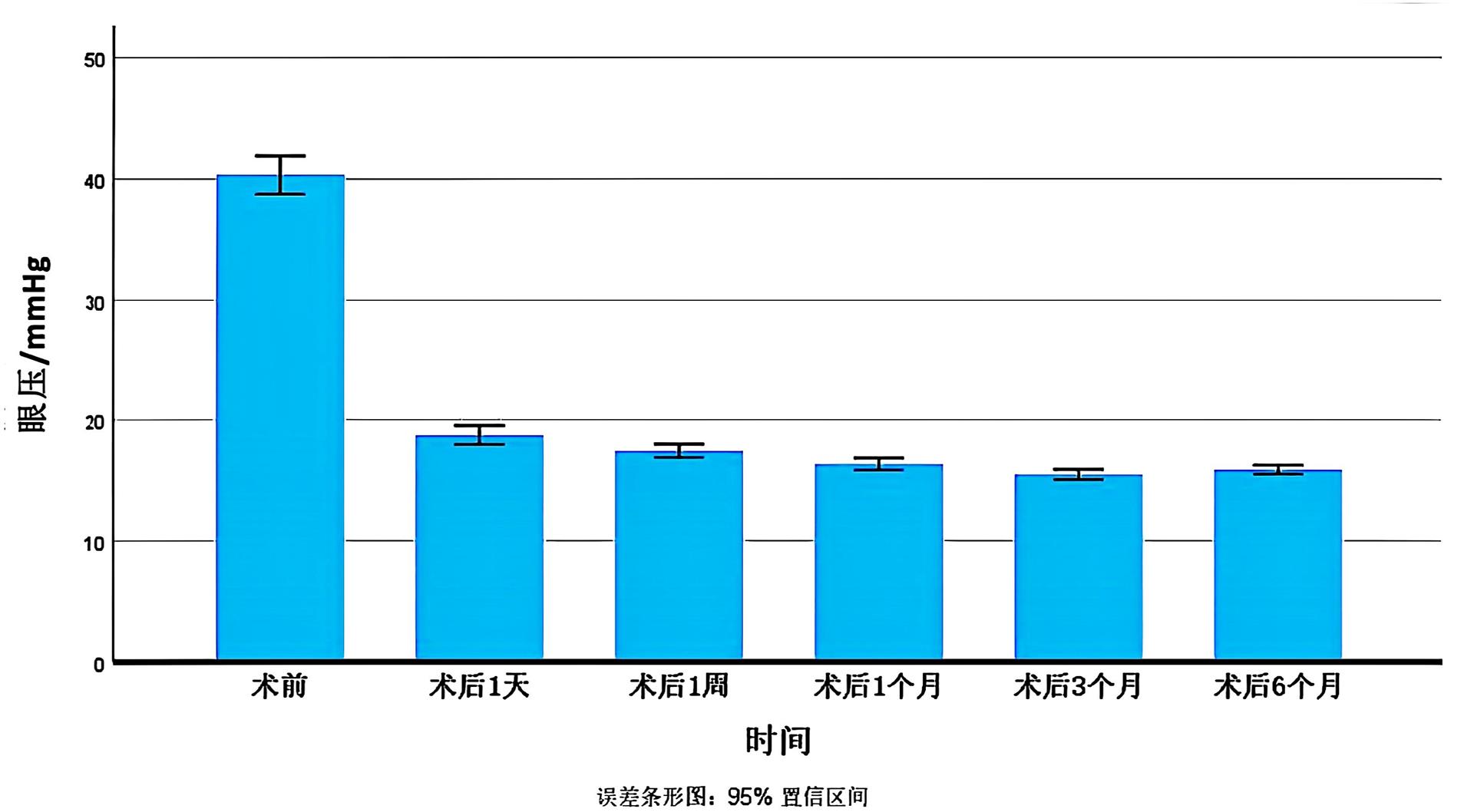
表2 纳入患者手术前后眼压比较(n=133)
Table 2 Comparison of intraocular pressure before and after surgery in the enrolled patients (n=133)
|
指标 |
术前 |
术后1天 |
术后1周 |
术后1个月 |
术后3个月 |
术后6个月 |
F |
P |
|
眼压(x±s)/mmHg |
40.32±9.15 |
18.76±4.53 |
17.45±3.22 |
16.37±2.88 |
15.50±2.50 |
15.90±2.19 |
189.79 |
<0.001 |
|
眼压下降率/% |
|
53 |
57 |
59 |
62 |
61 |
|
|
|
与术前成对比较 |
平均值差值 |
21.56 |
22.87 |
23.95 |
24.82 |
24.41 |
|
|
|
|
P |
<0.001 |
<0.001 |
<0.001 |
<0.001 |
<0.001 |
|
|
2.4 手术前后BCVA比较
纳入患者术前BCVA(logMAR)为0.40(0.22, 1.00),相较于该基线水平,术后各时间点BCVA均较术前有所提升,差异具有统计学意义(P<0.05)。详见表3。
表3 纳入患者手术前后BCVA比较(n=133)
Table 3 Comparison of best corrected visual acuity (BCVA) before and after surgery in the enrolled patients (n=133)
2.5术中和术后并发症
术后1周中31眼出现角膜水肿(23%),15眼出现前房积血(11%),均在1周内消退;另有1例患者出现眼压反跳,予前房穿刺放液等治疗1个月后,眼压恢复到正常范围,至术后6个月随访时,该患者在未使用抗青光眼药物的情况下眼压<21 mmHg。本研究纳入患者未发生玻璃体腔积血、后弹力层脱离等严重并发症,所有患者均无需再次手术。3 讨论
微创青光眼手术的进步为中晚期CPACG的治疗带来了新的术式选择,其中,PEI联合GSL及GT凭借其微切口、创伤小、疗效确切以及并发症少等优势,日益受到临床关注[13-14]。该联合手术通过多重机制协同作用:PEI能够有效解除瞳孔阻滞,并加深前房深度;在此基础上,GSL可机械性地分离已形成的周边虹膜前粘连(peripheral anterior synechia,PAS),促使房角重新开放;而GT则通过切开或去除功能异常的小梁网,直接减少房水流入Schlemm管的阻力,三者相辅相成,从而更有效地降低眼压,提高手术成功率[15-16]。然而,对于CPACG合并白内障的患者,在行PEI联合GSL后是否应进一步行GT仍有待探讨。目前国内、国外已有少量相关研究。张楠等[17]观察了PEI联合GSL与PEI联合GT治疗合并白内障的PACG的效果,发现两种手术方式均能有效地控制眼压并提高视力,其中PEI联合GT能更显著地降低眼压,但并发症风险较高,而PEI联合GSL则更有利于前房结构的恢复,且术后并发症较少。高思佳等[18]对比了PEI联合GSL和PEI联合GSL及GT治疗中晚期PACG合并白内障的疗效,结果术后6个月时2组患者的抗青光眼药物使用数量、BCVA、前房深度、房角关闭范围均较术前改善,但PEI联合GSL及 GT组平均降眼压效果及术后房角开放范围均优于PEI联合GSL组。一项回顾性病例研究分析了560例采用谷户钩行GT联合或不联合PEI治疗各类青光眼的疗效,其中包括71例PACG患者,最长随访时间达36个月,结果显示PACG患者术后眼压降低了31%,约64%的患眼在末次随访时使用抗青光眼药物后眼压可控制在15 mmHg以下[9]。一项前瞻性临床研究观察了采用Kahook双刃刀(Kahook dual blade,KDB)行PEI联合GSL及GT的11例PACG患者11眼,术后24个月眼压降低了约30%,抗青光眼药物减少了50%[19]。另一项回顾性研究同样观察了采用KDB行PEI联合GSL及GT的PACG患者24例42眼,结果95.2%的患眼在术后24个月眼压均不超过18 mmHg,且69.0%患眼无需使用抗青光眼药物[20]。Shokoohi-Rad等[21]将既往无眼内手术史的PACG患者61例63眼随机分为PEI联合GSL组和PEI联合GSL及GT组,观察2组患眼术后的眼压情况,结果发现PEI联合GSL及GT组的平均眼压降低效果(6.98 mmHg)优于PEI联合GSL组(4.60 mmHg),且在术后3个月及6个月时差异显著。一项多中心临床研究纳入了行PEI联合GSL及GT的晚期PACG患者83例83眼,随访1年,结果术后平均眼压[(14.2±2.6)mmHg]较术前[(27.4±7.3)mmHg]显著降低,且抗青光眼药物的平均种类由术前2.0种降至0.3种[22]。由此可见,PEI联合GSL及GT的降眼压效果比PEI联合GSL更加明显。
本研究中,术后1周和1、3、6个月的手术总成功率均高于80%,且手术成功率随术后时间延长而升高,这表明PEI联合GSL及GT在术后早、中期均体现出很好的疗效。术后1天,1周,1、3、6个月眼压均较术前明显下降,BCVA均较术前有所提升,降眼压药物数量较术前显著减少。既往研究结果显示,小梁切除术后易发生浅前房、低眼压、脉络膜脱离、滤泡瘢痕化等并发症,而本研究中术后主要并发症为角膜水肿(23%)、前房积血(11%),并发症发生率明显低于小梁切除术,且未出现严重影响视力的并发症[23]。
术后观察期内,1例患者出现了眼压反跳现象,考虑其潜在原因为术后局部使用糖皮质激素,或前房积血对房角引流功能产生的暂时性影响。经停用糖皮质激素或待前房积血吸收等干预后,眼压可得到控制并恢复至正常范围内,与既往研究结果相似[19]。
既往研究指出,采用PEI联合GSL治疗中晚期CPACG时,即使术中实现360°房角分离,术后仍存在房角再粘连的风险,从而导致眼压回升,该文献报道了PEI联合GSL治疗CPACG合并白内障的临床疗效,结果显示术后1周时眼压下降最明显,之后随时间的推移缓慢升高[24]。本研究结果显示,患者眼压下降率在术后3个月达到峰值,且各时间点的下降幅度均高于术后1天水平。这一差异提示,在PEI与GSL松解房角粘连的基础上,联合GT可能进一步促使小梁网-Schlemm管通路实现更充分、持久的开放,从而增强房水引流效率,使降眼压的效果更加持久,与既往关于GT可优化房水流出通道功能的研究结论相一致[18,21]。
综上所述,本研究结果初步表明,在6个月的随访期间,PEI联合GSL及GT用于治疗中晚期CPACG合并白内障的手术效果良好,创伤小、对患者影响轻微,在临床上易于开展和推广,可以作为治疗中晚期CPACG合并白内障的首选治疗方案。需要指出的是,本研究存在一定的局限性:首先,本研究为回顾性研究,缺乏前瞻性随机对照及独立的对照组,可能引入选择偏倚;其次,相对较短的随访时间限制了评估结论的长期有效性。未来将延长随访时间并加入对照组进行比较,以更全面地评估PEI联合GSL及GT治疗中晚期CPACG合并白内障的有效性及安全性。
声明
在论文撰写中无使用生成式人工智能。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。利益冲突
所有作者均声明不存在利益冲突。开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。基金
参考文献
Yu MB. Prioritizing prevention and treatment of high intraocular pressure and glaucoma following congenital cataract surgery[J]. Yan Ke Xue Bao, 2024, 39(5):229-233. DOI:10.12419/24032501.
Zhang H, Zhang Y, Zhang S. Lens zonulopathy and primary angle closure glaucoma:what we know and what we don't know[J]. Yan Ke Xue Bao, 2023, 38(2): 140-147. DOI:10.12419/j.issn.1000-4432.2023.02.10.
Ma Q, Yan M, Ma YL, et al. Phacoemulsification combined with goniosynechialysis under the gonioscope in the treatment of acute angle-closure glaucoma with cataract[J]. Int Eye Sci, 2022, 22(1): 91-94. DOI:10.3969/j.issn.1674-1412.2024.09.018.
Glaucoma Group of Ophthalmology Branch of Chinese Medical Association. Chinese consensus on the selection of indications for minimally invasive glaucoma surgery (2023)[J]. Chin J Exp Ophthalmol, 2023, 41(6): 521-526. DOI:10.3760/cma.j.cn115989-20230311-00083.
Shu J, Li Q. History of schlemm’s canal surgery[J]. Yan Ke Xue Bao, 2020, 35(4): 262-270. DOI:10.3978/j.issn.1000-4432.2020.10.02.
Song YH, Zhang YZ, Lin FB, et al. Outcomes and safety of phacoemulsification combined with intraocular lens implantation plus goniosynechialysis and goniotomy for advanced primary angle-closure glaucoma[J]. Chin J Exp Ophthalmol, 2022, 40(4): 334-339. DOI:10.3760/cma.j.cn115989-20211215-00692.
Xiao X. The safety and efficacy of PEI+GSL+GT in the treatmentof angle-closure glaucoma with cataract: a meta-analysis. Chengdu: Chengdu University of TCM, 2024. DOI:10.26988/d.cnki.gcdzu.2024.000193.
Zhang X, Song YH, Gao XB, et al. Advances of minimally invasive glaucoma surgery in the combined treatment of primary angle-closure glaucoma[J]. Chin J Ophthalmol, 2022, 58(1): 63-68. DOI:10.3760/cma.j.cn112142-20210904-00410.
Zhang N, Chen G, Zhang R. Comparison of the efficacy between trabeculectomy and goniosynechialysis in the treatment of primary angle-closure glaucoma with cataract[J]. Chin J Ocul Trauma Occup Eye Dis, 2024, 46(6): 424-431. DOI:10.3760/cma.j.cn116022-20240131-00023.
Gao SJ, Wen Y, Wan (Q/X)(Q/X), et al. Phacoemulsification with intraocular lens implantation plus goniosynechialysis and goniotomy under intraoperative gonioscope for the treatment of advanced primary angle-closure glaucoma with cataract[J]. Int Eye Sci, 2024, 24(6): 864-869. DOI:10.3980/j.issn.1672-5123.2024.6.05.
Li WN, Li CM, Wu XY. Phacoemulsification combined with goniosynechialysis under gonioscopy in the treatment of chronic primary angle-closure glaucoma with cataract[J]. J Clin Ophthalmol, 2023, 31(1): 40-43. DOI:10.3969/j.issn.1006-8422.2023.01.010.