昼夜节律与儿童近视发展机制的研究进展
阅读量:1062
DOI:10.12419/25032902
发布日期:2025-10-28
作者:
熊雅楠 ,易湘龙
展开更多 '%20fill='white'%20fill-opacity='0.01'/%3e%3cmask%20id='mask0_3477_29692'%20style='mask-type:luminance'%20maskUnits='userSpaceOnUse'%20x='0'%20y='0'%20width='16'%20height='16'%3e%3crect%20id='&%23232;&%23146;&%23153;&%23231;&%23137;&%23136;_2'%20x='16'%20width='16'%20height='16'%20transform='rotate(90%2016%200)'%20fill='white'/%3e%3c/mask%3e%3cg%20mask='url(%23mask0_3477_29692)'%3e%3cpath%20id='&%23232;&%23183;&%23175;&%23229;&%23190;&%23132;'%20d='M14%205L8%2011L2%205'%20stroke='%23333333'%20stroke-width='1.5'%20stroke-linecap='round'%20stroke-linejoin='round'/%3e%3c/g%3e%3c/g%3e%3c/svg%3e)
关键词
近视
生物钟
昼夜节律
多巴胺
摘要
近视已成为全球性流行病,预计到2050年全球将有近半数人群发生近视,已成为全球性重大功能卫生问题。近视不仅影响视力,还增加黄斑病变、青光眼等致盲性疾病的风险。近视的发病机制尚未完全明确,但与环境、遗传因素及昼夜节律紊乱密切相关。昼夜节律通过调节光照、多巴胺代谢和视网膜信号传导等机制影响近视的发生和发展。光照是调节昼夜节律的关键,户外活动时的高光照强度能有效刺激多巴胺分泌,抑制眼轴增长,减少近视发生,而异常光照模式(如夜间光暴露)则会干扰此过程。其次,睡眠不足与儿童近视患病率呈负相关,眼部关键参数(如眼轴长度、玻璃体腔深度等)均呈现显著的昼夜节律性波动。多巴胺作为视网膜中的重要神经递质,受生物钟基因调控,具有抑制眼轴生长的作用。视网膜中的生物钟基因和光敏色素也参与调节眼球生长,自主神经系统则通过调节脉络膜厚度与血流灌注参与眼球生长调控。动物实验和临床研究表明,昼夜节律紊乱会导致眼轴增长和近视进展。未来研究应进一步探讨昼夜节律与近视的因果关系、多巴胺代谢的调控机制以及生物钟基因的功能,以制定有效的近视防控策略。
全文
文章亮点
1. 关键发现
• 昼夜节律紊乱是近视发生和发展的潜在风险因素。• 生物钟基因的表达异常与近视的病理机制密切相关。
• 视网膜多巴胺的代谢受昼夜节律调控,其分泌异常会促进眼轴增长和近视进展。
• 调控生物节律的关键基因 ( 生物钟基因 ) 和神经递质 ( 如多巴胺、褪黑素 ) 可能为近视防治提供新的干预靶点。
2. 已知与发现
• 已知近视是由遗传和环境因素共同作用的疾病,但其内在生物学机制尚不明确。户外活动可有效预防近视,其核心机制可能与高强度、全光谱的自然光照有关。研究发现近视的两个关键特征——脉络膜变薄和眼轴延长,均表现出昼夜节律性。光照通过调节视网膜多巴胺的释放来抑制眼轴生长,而多巴胺的合成与代谢受生物钟基因调控。基因敲除研究表明,生物钟基因缺失会导致眼轴异常增长和屈光不正。自主神经系统 ( 特别是副交感神经 ) 参与调控脉络膜厚度和眼轴生长的昼夜节律,其功能失衡会促进近视进展。3. 意义与改变
• 该发现为近视的发病机制开辟了全新的研究方向,将研究视角从传统的遗传和环境因素,延伸至生物节律调控的分子层面。同时为近视防控提供了新的指导思路,例如通过维持规律的作息、保证充足的睡眠和增加户外活动时间来稳定昼夜节律。未来研究方向:需要进一步阐明视网膜中感知光照和调控眼轴生长的具体细胞与分子通路,并深入探索昼夜节律紊乱与近视之间的因果关系,以推动研究成果向临床转化。近年来,近视患病人群呈逐年增加趋势,据世界卫生组织估计,预测显示到2050年全球近视患者将增至47.58亿,其中高度近视人群预计达9.38亿[1]。近视不仅因视力模糊、佩戴眼镜会导致生活上的不便,更容易引起多种致盲性眼病,如高度近视性脉络膜视网膜病变、黄斑病变、视网膜脱离、青光眼和白内障[2]等。近年来近视开始呈现低龄化、高度近视化发展趋势,已逐渐发展成为导致青少年视力受损的首要因素,这一现象不仅引发了国家层面的高度重视,也吸引了学术界的广泛研究兴趣。然而,关于近视发生和恶化的内在生物学机制,目前仍缺乏明确的科学解释。一直以来的观点认为,近视是一类由环境因素与遗传因素共同影响的疾病。研究表明,近视的发病机制被认为由多重因素共同调控,包括远视性离焦(源于眼球调节功能滞后)、视网膜周边离焦状态异常,以及脉络膜血流低灌注诱发的巩膜缺氧性变薄与结构重塑。研究表明,近视的发生、发展可能呈现昼夜节律性的特征[3]。随着基因组学研究的深入,科学家发现一类调控生物节律的关键基因——生物钟基因,其表达异常不仅与近视的病理机制密切相关,还可能为近视的防治提供新的干预靶点。这一发现为探索近视的发病机制开辟了新的研究方向,为近视防控提供新的指导思路。
1 昼夜节律与近视的关系
昼夜节律,又称为生物钟,是生物体在24 h周期内的生理和行为变化,受内源性生物钟和外界环境(如光照)的共同调节。人体的昼夜节律主要由位于下丘脑的视交叉上核(suprachiasmat-icnucleus, SCN)主导,该核团通过视网膜输入的光信号传导,进而经神经传导和内分泌调节等方式协调生理行为的周期性振荡,控制机体的睡眠-觉醒节律,并同步调节体温、心率和各类激素分泌等基础生理功能[4]。昼夜节律系统失调已被逐步证实为近视发生的潜在风险因素。睡眠障碍作为其下游表现,可能通过介导光信号-神经内分泌通路(如褪黑素-多巴胺轴)异常,参与调控眼轴增长及屈光发育。横断面研究进一步表明,近视儿童中睡眠紊乱的患病率升高,暗示生物钟紊乱在近视病理进程中的潜在作用[5]。从病理机制来看,近视发生的两个关键特征——脉络膜变薄和眼轴延长均表现出明显的昼夜节律依赖性[6]。具体而言,脉络膜作为巩膜的主要供氧来源,其厚度减少会导致毛细血管通透性和血流量下降,进而引发巩膜缺氧及病理性重塑,最终促进眼轴增长和近视进展[7]。1.1 昼夜节律与眼轴改变
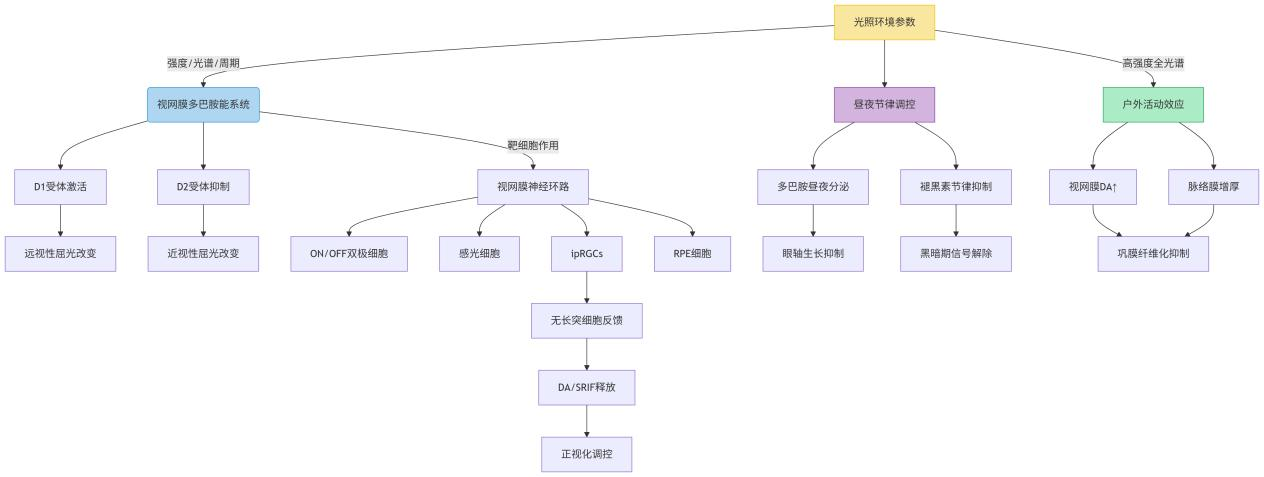
光照作为调节昼夜节律的关键环境因子,其参数特征(包括强度、光谱和周期)对眼部生理稳态具有显著影响,尤其在眼球屈光发育的关键期。适宜的光照暴露(如足够的光强度和规律的光周期)对于维持视网膜多巴胺能神经元的正常功能、调控眼轴生长速率以及维持脉络膜-巩膜信号通路的稳态至关重要[8]。既往多项动物实验研究提出:异常光照条件(持续光照或持续黑暗)可显著干扰雏鸡的眼球发育进程。这一现象提示,昼夜节律信号的缺失可能通过破坏正常的眼生长调控机制,最终导致眼球异常发育及屈光不正的发生[9-10]。Nickla等[11]研究发现雏鸡夜间暴露于光线下2 h,其脉络膜厚度(Choroid thickness,ChT)和眼轴长度的昼夜节律会受到干扰,进而出现近视进展。鉴于哺乳动物与禽类在眼球发育机制上存在显著差异,研究者转向哺乳动物模型开展深入探究。对3组小鼠分别进行6、12、18 h的持续照明,结果发现延长光照时间可诱导小鼠产生相对性近视,其特征性改变包括玻璃体腔深度增加以及视网膜厚度变薄等形态学变化[12]。流行病学研究显示,户外活动时长与近视患病率之间存在显著负相关关系,提示增加户外暴露时间可作为近视防控的有效干预策略。究其原因,户外与室内光照环境存在本质差异:一方面,自然光与人造光源在光谱组成上具有显著区别;另一方面,户外光照强度普遍高于室内环境。这种高强度的全光谱光照环境,可能是户外活动发挥近视防控作用的关键机制。既往动物实验中,强光暴露组豚鼠呈现出显著的屈光发育特征:其远视屈光度显著高于正常光照组和弱光组(P < 0.05),同时伴有明显的眼轴生长抑制现象。值得注意的是,三组实验动物的角膜曲率参数未呈现统计学差异(P > 0.05)。这些数据表明,高强度光照主要通过调控眼轴生长而非改变角膜形态来影响屈光发育进程[13]。
1.2 睡眠与近视的关系
Gong等[14]首次提出了睡眠不足可能与近视患病风险相关联的假设。随后的横断面研究进一步证实了这一观点,发现儿童的睡眠时间与近视患病率之间存在负相关关系,即睡眠时间越短,近视患病率越高。针对中国中小学生的多项研究也指出,充足的睡眠是保护视力、降低近视发生风险的重要因素。然而,值得注意的是,不同年龄段的儿童所需的睡眠时间存在差异[15]。一项针对5~14岁儿童进行的观察性研究,深入分析了他们的24 h习惯性睡眠/觉醒模式对眼部参数的影响。研究揭示了儿童眼部参数的昼夜动态变化规律:角膜中央厚度、角膜屈光度、晶状体厚度、玻璃体腔深度以及眼轴长度等多个眼部关键参数均发生了显著变化。中央角膜厚度、角膜屈光力、玻璃体腔深度和眼轴长度在24 h测量期间表现出显著的昼夜变化:平均中央角膜厚度在清晨黑暗期4.27 h出现峰值相。角膜屈光力在下午13.92 h最大。平均玻璃体腔深度峰值期为15.91 h。平均眼轴长度峰值出现在下午12.92 h。眼轴长度与ChT呈现显著的相位性负相关,即当眼轴增长时,ChT会相应减少。这一发现对于理解儿童近视的进展过程具有重要意义,提示我们儿童的睡眠/觉醒模式可能与近视的进展密切相关[16]。国外首次对学龄前儿童睡眠时长与近视的关联进行的纵向研究是法国伊甸园出生队列研究( birth-cohort,EDEN)[17],该研究通过追踪观察发现:2岁幼儿的睡眠时长与5岁时的屈光矫正需求呈现显著U型曲线关系,即2岁时睡眠时间不足或过长均会增加5岁时戴眼镜的风险。2 昼夜节律与近视进展机制研究
2.1 多巴胺代谢的调节
作为昼夜节律的关键调控分子,多巴胺(dopamine, DA)和褪黑素在人体内呈现互补的昼夜分泌模式。多巴胺作为儿茶酚胺类神经递质,其合成与分泌主要受日间光照刺激调控;而褪黑素作为吲哚胺类激素,则在夜间黑暗环境下大量释放。这两种物质通过协同作用共同维持机体内源性生物钟的稳定运行。DA是视网膜中重要的神经递质,具有调节眼轴生长的作用,其广泛分布于眼内各层结构,其中含量最丰富处为视网膜[18]。视网膜多巴胺受体亚型呈现明显的细胞特异性分布模式:D1型受体(D1R)在神经节细胞层(retinal ganglion cell layer,RGCL)、无长突细胞(amacrine cells,ACs)及双极细胞(bipolar cells,BCs)中高表达;而D2型受体(D2R)则选择性富集于视网膜色素上皮 (retinal pigment epithelium, RPE)细胞的顶膜(apical membrane)和基底膜(basolateral membrane)结构域,同时在无长突细胞中作为突触前自身受体(presynaptic autoreceptor)参与神经递质释放的负反馈调控。作为视网膜昼夜节律的核心调控分子,多巴胺的生物合成与代谢通路受到生物钟基因的精确调控,其相关酶的活性均呈现明显的昼夜节律性变化[19],具有抑制眼球轴向生长的作用。光照促进多巴胺的释放,进而抑制近视的发生、发展[20]。最新研究表明,多巴胺D1和D2受体在眼球屈光发育过程中呈现拮抗作用[21]。具体表现:D1受体的过度激活可促进远视性屈光改变,而D2受体的异常活化则会加速近视进展,二者共同构成调控眼球正视化的双向平衡系统 [22]。目前研究已经发现,DA受体可能通过以下细胞靶点调控视觉通路:1)视网膜 ON/OFF 双极细胞 [23];2)视网膜感光细胞 [24];3)视网膜神经节细胞(ipRGCs) [25];4)RPE 细胞 [26-27],这些受体可能通过与多种神经递质及细胞内信号转导通路的协同作用,参与调控眼球的发育过程。视网膜神经节细胞是哺乳动物视网膜除了视锥细胞和视杆细胞外的第3类特殊类型的神经节细胞,Vuong 团队[28]发现,M1型 ipRGCs与分泌DA和生长激素释放抑制因子(somatotropin release-inhibiting factor, SRIF) 的无长突细胞形成视网膜内反馈回路,影响昼夜节律调节和光反射调控等非视觉功能。2.2 视网膜调控机制
视网膜是昼夜节律的重要调节器官。视网膜具备双重生理功能:作为外周光感受器将光信息经视觉通路传递至高级中枢;同时作为自主节律发生器,其内源性昼夜节律系统可独立于中枢生物钟系统维持稳定的节律输出[29]。视网膜组织中存在一系列具有昼夜节律表达特性的核心时钟基因,主要包括时钟调节器(Clock)、脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(Bmal1)、周期蛋白(period,Per)、隐花色素(cryptochorme,Cry)等,这些基因通过转录-翻译反馈环路(TTFL)机制,在视网膜细胞中维持自主的昼夜节律振荡[30]。“核心” 时钟基因Clock和BMAL1为编码激活子,PER1、PER2、PER3、CRY1和CRY2为编码抑制子的[31]。Hastings等[32]的研究揭示了视网膜光感受器细胞生物钟的特异性:1) Clock和BMAL1基因表达在光照期达峰,而PER1/3则在暗期呈现峰值表达;2) 这种Clock/BMAL1与PERs的同步振荡模式具有视网膜组织特异性,在其他组织(包括SCN)中未被观察到。哺乳动物的生物钟调控系统核心由两个相互耦联的转录-翻译反馈环路(TTFL)构成:正调控元件:Clock/Bmal1异二聚体、负调控元件:PER/CRY蛋白复合体。生物钟系统的正向调节组件涵盖了一系列转录因子:bHLH-PAS(basic helix-loop-helix-Per-Arnt-Sim)结构域转录因子、Clock基因编码产物以及BMAL1蛋白。这些转录因子通过以下分子机制发挥作用:形成功能性异源二聚体,特异性识别并结合E-box增强子元件,显著增强负向调节元件的转录活性——包括Period基因家族(PER1/2)以及Cryptochrome基因家族(CRY1/2)。另一方面,PER和CRY蛋白质则构成了负向调节组件。它们通过直接结合CLOCK/BMAL1二聚体,阻断其转录激活功能,从而抑制自身基因表达,形成了一个闭环的调节系统。第二个反馈回路:生物钟基因视黄酸受体相关的孤儿受体α(orphan receptor α, Rorα)作为一种正性调节因子,与Bmal1基因启动子区域Rorα结合元件RRE,从而促进Bmal1的转录,而Rev-erb水平的降低,将开始新一轮的转录激活。生物钟系统的核心转录调控机制依赖于BMAL1/Clock复合物的特异性DNA结合活性,该复合物精确识别靶基因启动子区域的E-box顺式作用元件,进而直接调控下游节律相关基因的周期性转录。这种时序特异的转录调控最终转化为多种生理功能的昼夜节律性表达[33]。随着研究的不断深入,科学家通过基因编辑技术构建了节律基因敲除动物模型。在哺乳动物模型中,与野生型对照相比,节律基因敲除小鼠随发育进程呈现显著屈光不正,眼轴异常增长、玻璃体腔深度增加,在果蝇的模型中也发现类似变化,“时钟基因”敲除后导致近视的发生[34]。2.3 褪黑素代谢的调节
眼部光感受器与内源性生物钟通过协同作用构成双向调控网络,通过调控褪黑素的分泌来管理昼夜节律。而昼夜节律的变动,又反过来通过影响褪黑激素的分泌,来调节人体的多种生理机能,其中也包括视网膜的功能。异常光环境暴露,尤其是夜间人造光照暴露,可能会干扰视网膜生物钟并影响视觉系统稳态:导致昼夜节律失调,抑制内源性褪黑激素的分泌,增加近视进展风险[35]。Rada 等[36]的实验证明了通过外源性褪黑激素干预可诱导近视雏鸡模型出现ChT显著减少,近视屈光度进展加速。研究提示视网膜可能通过独特的转录调控网络维持其自主节律。深入研究表明,ipRGC所介导的视黑素信号通路与传统光感受器信号通路分别通过调控眼轴生长和角膜曲率变化来影响眼球发育进程。在明视条件下,ipRGCs 的光激活主要由黑视素蛋白介导,通过光信号级联直接响应强光刺激,形成其直接光反应;暗视条件下,ipRGCs 则主要依赖视杆细胞和视锥细胞的光信号输入,从而产生间接光反应。研究证实,选择性破坏小鼠ipRGC细胞或特异性激活该细胞群,可导致发育期小鼠分别产生明显的近视或远视屈光变化[37]。ipRGCs通过其树突和胞体广泛分布的黑视素蛋白感光色素,能够将光量子信号转化为动作电位频率的变化,从而直接将环境光照信息传递至中枢昼夜节律调控核团(主要为视交叉上核,SCN),进而介导多项非成像视觉功能:1)昼夜节律的光周期夹带;2)瞳孔对光反射的调节;3)松果体对褪黑激素分泌的抑制。值得注意的是,该通路通过调控多巴胺能信号转导等机制,已被证实可影响眼球正视化进程[38]。研究证据表明,黑视蛋白在屈光发育调控中扮演关键角色:Kofuji 等[39]研究发现,当利用遗传学技术使小鼠 ipRGCs 中的黑视蛋白基因表达沉默后,其瞳孔对光反射、运动活动的光调节以及昼夜节律的光抑制功能均出现显著缺陷。同时当其表达缺失时,可导致视网膜多巴胺能信号转导功能受损,继而引发异常的眼轴生长调控[40]。2.4 自主神经的调节
人眼自主神经主要包括副交感神经与交感神经。通过释放去甲肾上腺素(noradrenaline, NE)激活β-肾上腺素受体(β-adrenergic receptor, β-AR),抑制视网膜多巴胺释放,促进眼轴增长。副交感神经(parasympathetic nerve, PNS)通过胆碱能受体(如M1/M3)可能拮抗交感作用,但具体机制尚不明确。在动物模型中,睫状神经节(副交感神经节)切除可加速近视进展。近年来研究表明,ChT与近视进展存在显著关联。其作用机制主要体现在两个方面:一方面通过动态调节视网膜焦平面参与视觉成像过程;另一方面通过调控多种生长因子的分泌模式,进而影响巩膜的重塑过程[41]。近期研究表明,近视进展过程中脉络膜(choroid)的调控机制涉及多因素相互作用:近视患者表现出显著的ChT变薄,这一病理变化与脉络膜血流灌注(choroidal blood flow, ChBF)降低及非血管平滑肌(nonvascular smooth muscle, NVSM)功能障碍存在显著相关性。动物研究中也有相似发现,在豚鼠近视模型的研究中,ChT和脉络膜血流灌注均显著降低,在近视恢复期升高;ChT的变化与脉络膜血流的变化呈正相关[42]。脉络膜血管和NVSM受自主神经系统(包括交感和副交感神经)的双重调控,这种神经支配不仅参与ChT的动态调节,还可能直接影响近视进展过程。最新研究证据表明,眼球的昼夜节律调控高度依赖于自主神经系统的功能完整性。当这种生物节律发生紊乱时,可能通过调控巩膜重塑过程而促进病理性眼轴增长。值得注意的是,副交感神经功能下调会破坏原有的神经调控平衡,进而促进近视进展的病理生理过程。Chakraborty等[43]通过实验性睫状神经节切除术证实,该干预可显著逆转雏鸡ChT昼夜节律,表现为夜间变薄而日间增厚,最终促进眼轴增长。进一步研究发现,Nickla等[44]采用完全性副交感神经切断术后,雏鸡模型表现出脉络膜及眼轴节律的超节律性改变,其特征为节律振幅显著增大,并伴随眼轴生长速率加快。这些发现共同提示副交感神经调控在眼球节律性生长中的关键作用。
图1 昼夜节律与儿童近视进展的关联
Figure 1: The Association between Circadian Rhythm and the Progression of Myopia in Children
3 未来研究方向
3.1昼夜节律与近视之间的因果关系
目前的研究认为,昼夜节律的紊乱会显著影响近视的进展,这种关联主要是通过视网膜生物钟的功能调控以及相关神经化学信号的分泌等途径来介导的。不过,研究者对于视网膜介导眼球生长调控的具体分子机制和理论体系尚未完全阐明。目前仍存在几个关键科学问题亟待解决:视网膜中哪些特定细胞亚群负责感知光照刺激?这些细胞通过何种信号通路传递光信息?以及这些分子信号如何精确调控眼轴发育?后续研究应重点阐明昼夜节律如何通过分子层面调控视网膜细胞的功能活动。此外,了解昼夜节律紊乱如何导致近视的发生也是一个重要课题。这些研究不仅深化了对近视病理生理机制的系统性认识,同时为开发基于生物节律调控的靶向干预策略提供了理论依据,该研究具有以下重要价值:1)为近视的早期预防提供了新的分子靶点;2)为临床治疗策略的优化奠定了转化医学基础;3)推动了从发病机制到临床应用的转化研究。3.2 多巴胺代谢的调控
多巴胺在昼夜节律对近视进展的影响机制中具有重要作用,但其与其他因子及信号通路的相互作用研究尚不清楚,以及多巴胺受体激动剂或其他药物在近视治疗中的潜在应用也需进一步研究。3.3生物钟基因的功能研究
尽管动物模型,尤其是啮齿类动物,在揭示近视病理生理机制研究中发挥了重要价值,但它们与人类在活动/休息节律、生物钟基因表达、眼球发育调控机制上存在差异,这些局限使动物实验数据在解释人类近视发病机制时的外推效度受到限制。此外,目前关于生物钟调控近视的研究仍存在明显局限:一方面现有研究样本量偏少,另一方面机制探索不够深入,导致难以系统阐明生物钟基因参与近视发生的确切分子通路。未来的研究需更加深入地探讨不同个体间的内源性授时因子(生物钟基因多态性、节律相关转录组特征)及外源性环境因素(光照参数动态变化、行为模式差异)差异,因为这些因素均可影响疾病的发展进程。通过这样的研究,我们期望能够明确不同生物节律对个体近视发生和发展的具体影响,从而为制定更加个性化的近视预防和治疗策略提供科学依据。4 结论
昼夜节律紊乱可能通过影响光照感知、多巴胺代谢和视网膜信号传导等方式,在儿童近视的发生和发展中起到重要作用。未来的研究应进一步揭示其分子机制,并探索基于昼夜节律的近视防控策略。声明
在论文撰写中未使用生成式人工智能服务。论文撰写中的所有内容均由作者独立完成,并对出版物的真实性和准确性承担全部责任。利益冲突
所有作者均声明不存在利益冲突。开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。基金
1. 自治区自然科学基金重点项目(2022D01D68);自治区天山英才医药卫生高层次人才-领军人才(TSYC202301A007)。
This work was supported by Key Project of the Natural Science Foundation of the Autonomous Region (2022D01D68);Leading Talent in the Medical and Health High-Level Talent Program of the "Tianshan Talents" Initiative of the Autonomous Region (TSYC202301A007).
This work was supported by Key Project of the Natural Science Foundation of the Autonomous Region (2022D01D68);Leading Talent in the Medical and Health High-Level Talent Program of the "Tianshan Talents" Initiative of the Autonomous Region (TSYC202301A007).
参考文献
1. Erping L. Natural selection contributes to the myopia epidemic[J]. Natl Sci Rev, 2021, 8(6): 122-129. DOI:10.1093/nsr/nwaa175.
2. Jonas JB, Ang M, Cho P, et al. IMI prevention of myopia and its progression[J]. Invest Ophthalmol Vis Sci, 2021, 62(5): 6. DOI:10.1167/iovs.62.5.6.
3. Stone RA, Pardue MT, Iuvone PM, et al. Pharmacology of myopia and potential role for intrinsic retinal circadian rhythms[J]. Exp Eye Res, 2013, 114: 35-47. DOI:10.1016/j.exer.2013.01.001.
4. Fagiani F, Di Marino D, Romagnoli A, et al. Molecular regulations of circadian rhythm and implications for physiology and diseases[J]. Sig Transduct Target Ther, 2022, 7: 41. DOI:10.1038/s41392-022-00899-y.
5. Jee D, Morgan IG, Kim EC. Inverse relationship between sleep duration and myopia[J]. Acta Ophthalmol, 2016, 94(3): e204-10. DOI:10.1111/aos.12776.
6. 周琦, 祁玉麟, 薛愚愚, 等. 眼的生物钟调控机制研究进展[J]. 国际眼科杂志, 2022, 22(3): 416-419. DOI:10.3980/j.issn.1672-5123.2022.3.13.
Qi Z, YuLin Q, YuYu X, et al. Research progress on the regulation mechanism of the eye' s biological clock[J]. Int Eye Sci, 2022, 22(3): 416-419. DOI:10.3980/j.issn.1672-5123.2022.3.13.
Qi Z, YuLin Q, YuYu X, et al. Research progress on the regulation mechanism of the eye' s biological clock[J]. Int Eye Sci, 2022, 22(3): 416-419. DOI:10.3980/j.issn.1672-5123.2022.3.13.
7. Wu H, Chen W, Zhao F, et al. Scleral hypoxia is a target for myopia control[J]. Proc Natl Acad Sci U S A, 2018, 115(30): E7091-E7100. DOI:10.1073/pnas.1721443115.
8. Wirz-Justice A, Skene DJ, Münch M. The relevance of daylight for humans[J]. Biochem Pharmacol, 2021, 191: 114304. DOI:10.1016/j.bcp.2020.114304.
9. Lauber JK, SHUTZE JV MCGINNIS J. Effects of exposure to continuous light on the eye of the growing chick[J]. Proc Soc Exp Biol Med, 1961, 106: 871-872. DOI:10.3181/00379727-106-26505.
10. Lauber JK, McGinnis J. Eye lesions in domestic fowl reared under continuous light[J]. Vision Res, 1966, 6(12): 619-626. DOI:10.1016/0042-6989(66)90073-3.
11. Nickla DL, Wildsoet C, Wallman J. Visual influences on diurnal rhythms in ocular length and choroidal thickness in chick eyes[J]. Exp Eye Res, 1998, 66(2): 163-181. DOI:10.1006/exer.1997.0420.
12. Zhou X, An J, Wu X, et al. Relative axial myopia induced by prolonged light exposure in C57BL/6 mice[J]. Photochem & Photobiology, 2010, 86(1): 131-137. DOI:10.1111/j.1751-1097.2009.00637.x.
13. 赵颖熙. 光照强度对豚鼠屈光发育的影响及视网膜多巴胺变化研究[D]. 上海: 复旦大学, 2011.
Zhao YX. The research of the influence of light intensity on the refractive development and the retinal levels of dopamine in guinea pigs[D]. Shanghai: Fudan University, 2011.
Zhao YX. The research of the influence of light intensity on the refractive development and the retinal levels of dopamine in guinea pigs[D]. Shanghai: Fudan University, 2011.
14. Gong Y, Zhang X, Tian D, et al. Parental myopia, near work, hours of sleep and myopia in Chinese children[J]. Health, 2014, 6(1): 64-70. DOI:10.4236/health.2014.61010.
15. 许韶君, 万宇辉, 徐增辉, 等. 体育锻炼、睡眠和家庭作业时间与中小学生疑似近视的关系[J]. 中华流行病学杂志, 2016, 37(2): 183-186. DOI:10.3760/cma.j.issn.0254-6450.2016.02.006.
Xu SJ, Wan YH, Xu ZH, et al. Association between time spent on physical exercise, sleep, homework and suspected myopia among students[J]. Chin J Epidemiol, 2016, 37(2): 183-186. DOI:10.3760/cma.j.issn.0254-6450.2016.02.006.
Xu SJ, Wan YH, Xu ZH, et al. Association between time spent on physical exercise, sleep, homework and suspected myopia among students[J]. Chin J Epidemiol, 2016, 37(2): 183-186. DOI:10.3760/cma.j.issn.0254-6450.2016.02.006.
16. Ostrin LA, Jnawali A, Carkeet A, et al. Twenty-four hour ocular and systemic diurnal rhythms in children[J]. Ophthalmic Physiologic Optic, 2019, 39(5): 358-369. DOI:10.1111/opo.12633.
17. Rayapoullé A, Gronfier C, Forhan A, et al. Longitudinal association between sleep features and refractive errors in preschoolers from the EDEN birth-cohort[J]. Sci Rep, 2021, 11: 9044. DOI:10.1038/s41598-021-88756-w.
18. Zhou X, Pardue MT, Iuvone PM, et al. Dopamine signaling and myopia development: What are the key challenges[J]. Prog Retin Eye Res, 2017, 61: 60-71. DOI:10.1016/j.preteyeres.2017.06.003.
19. Verwey M, Dhir S, Amir S. Circadian influences on dopamine circuits of the brain: regulation of striatal rhythms of clock gene expression and implications for psychopathology and disease[J]. F1000Res, 2016, 5: F1000FacultyRev-F1000Facult2062. DOI:10.12688/f1000research.9180.1.
20. Landis EG, Chrenek MA, Chakraborty R, et al. Increased endogenous dopamine prevents myopia in mice[J]. Exp Eye Res, 2020, 193: 107956. DOI:10.1016/j.exer.2020.107956.
21. Zhang S, Yang J, Reinach PS, et al. Dopamine receptor subtypes mediate opposing effects on form deprivation myopia in pigmented guinea pigs[J]. Invest Ophthalmol Vis Sci, 2018, 59(11): 4441-4448. DOI:10.1167/iovs.17-21574.
22. Zhang J, Deng G. Protective effects of increased outdoor time against myopia: a review[J]. J Int Med Res, 2020, 48(3): 0300060519893866. DOI:10.1177/0300060519893866.
23. Yang J, Pahng J, Wang GY. Dopamine modulates the off pathway in light-adapted mouse retina[J]. J Neurosci Res, 2013, 91(1): 138-150. DOI:10.1002/jnr.23137.
24. Herrmann R, Heflin SJ, Hammond T, et al. Rod vision is controlled by dopamine-dependent sensitization of rod bipolar cells by GABA[J]. Neuron, 2011, 72(1): 101-110. DOI:10.1016/j.neuron.2011.07.030.
25. Bu JY, Li H, Gong HQ, et al. Gap junction permeability modulated by dopamine exerts effects on spatial and temporal correlation of retinal ganglion cells’ firing activities[J]. J Comput Neurosci, 2014, 36(1): 67-79. DOI:10.1007/s10827-013-0469-1.
26. Li HH, Sun YL, Cui DM, et al. Effect of dopamine on bone morphogenesis protein-2 expression in human retinal pigment epithelium[J]. Int J Ophthalmol, 2017, 10(9): 1370-1373. DOI:10.18240/ijo.2017.09.06.
27. Banerjee S, Wang Q, So CH, et al. Defocused images change multineuronal firing patterns in the mouse retina[J]. Cells, 2020, 9(3): 530. DOI:10.3390/cells9030530.
28. Vuong HE, Hardi CN, Barnes S, et al. Parallel inhibition of dopamine amacrine cells and intrinsically photosensitive retinal ganglion cells in a non-image-forming visual circuit of the mouse retina[J]. J Neurosci, 2015, 35(48): 15955-15970. DOI:10.1523/JNEUROSCI.3382-15.2015.
29. Ko GY. Circadian regulation in the retina: From molecules to network[J]. Eur J Neuroscience, 2020, 51(1): 194-216. DOI:10.1111/ejn.14185.
30. Miller S, Hirota T. Pharmacological interventions to circadian clocks and their molecular bases[J]. J Mol Biol, 2020, 432(12): 3498-3514. DOI:10.1016/j.jmb.2020.01.003.
31. Betts CA, Jagannath A, LE van Westering T, et al. Dystrophin involvement in peripheral circadian SRF signalling[J]. Life Sci Alliance, 2021, 4(10): e202101014. DOI:10.26508/lsa.202101014.
32. Hastings MH, Reddy AB, Maywood ES. A clockwork web: circadian timing in brain and periphery, in health and disease[J]. Nat Rev Neurosci, 2003, 4(8): 649-661. DOI:10.1038/nrn1177.
33. DeVera C, Baba K, Tosini G. Retinal Circadian Clocks are Major Players in the Modulation of Retinal Functions and Photoreceptor Viability. Yale J Biol Med. 2019, 92(2): 233-240.PMID: 31249484.
34. Stone RA, McGlinn AM, Chakraborty R, et al. Altered ocular parameters from circadian clock gene disruptions[J]. PLoS One, 2019, 14(6): e0217111. DOI:10.1371/journal.pone.0217111.
35. Tosini G, Ferguson I, Tsubota K. Effects of blue light on the circadian system and eye physiology[J]. Mol Vis, 2016, 22: 61-72.
36. Rada JAS, Wiechmann AF. Melatonin receptors in chick ocular tissues: implications for a role of melatonin in ocular growth regulation[J]. Invest Ophthalmol Vis Sci, 2006, 47(1): 25-33. DOI:10.1167/iovs.05-0195.
37. Liu AL, Liu YF, Wang G, et al. The role of ipRGCs in ocular growth and myopia development[J]. Sci Adv, 2022, 8(23): eabm9027. DOI:10.1126/sciadv.abm9027.
38. Panda S, Nayak SK, Campo B, et al. Illumination of the melanopsin signaling pathway[J]. Science, 2005, 307(5709): 600-604. DOI:10.1126/science.1105121.
39. Kofuji P, Mure LS, Massman LJ, et al. Intrinsically photosensitive retinal ganglion cells (ipRGCs) are necessary for light entrainment of peripheral clocks[J]. PLoS One, 2016, 11(12): e0168651. DOI:10.1371/journal.pone.0168651.
40. Chakraborty R, Landis EG, Mazade R, et al. Melanopsin modulates refractive development and myopia[J]. Exp Eye Res, 2022, 214: 108866. DOI:10.1016/j.exer.2021.108866.
41. Nickla DL, Wallman J. The multifunctional choroid[J]. Prog Retin Eye Res, 2010, 29(2): 144-168. DOI:10.1016/j.preteyeres.2009.12.002.
42. Zhang S, Zhang G, Zhou X, et al. Changes in choroidal thickness and choroidal blood perfusion in guinea pig myopia[J]. Invest Ophthalmol Vis Sci, 2019, 60(8): 3074. DOI:10.1167/iovs.18-26397.
43. Chakraborty R, Ostrin LA, Nickla DL, et al. Circadian rhythms, refractive development, and myopia[J]. Ophthalmic Physiol Opt, 2018, 38(3): 217-245. DOI:10.1111/opo.12453.
44. Nickla DL, Schroedl F. Effects of autonomic denervations on the rhythms in axial length and choroidal thickness in chicks[J]. J Comp Physiol A Neuroethol Sens Neural Behav Physiol, 2019, 205(1): 139-149. DOI:10.1007/s00359-018-01310-4.