登革相关眼病诊疗进展
关键词
摘要
全文
文章亮点
· 本文对DAOD展开了全方位的论述,全面涵盖了其流行病学特征、发病机制、临床表现、诊断方法以及个体化治疗策略等多个关键方面。
· DAOD的临床表现呈现出多样化的特点,其病症范围从可自行缓解的结膜出血,到足以威胁视力的神经炎症不等。而且,目前尚缺乏明确的诊断金标准,这些特性给临床诊疗工作带来了主要挑战。
· 本综述致力于为临床医师提供切实可行的实践指导,助力他们深入理解DAOD的发病机制,进而优化诊疗方案,最终实现降低患者致残率的目标。
登革热作为一种虫媒传染病,在全球范围内广泛传播,且影响深远,其危害不容小觑。近年来,登革热发病率在全球迅速上升,已从热带和亚热带逐渐向温带地区扩散,给全球公共卫生安全带来严峻挑战。随着登革热病例的不断增多,其引发的各种并发症也逐渐进入人们的视野,其中登革相关眼病(dengue-associated ocular diseases, DAOD)作为登革热感染的重要系统性并发症,正越来越受到医学界的关注。尽管已有一些关于DAOD的研究报道,但相较于登革热本身,针对DAOD的系统性研究仍相对匮乏,且在发病机制、诊断方法及治疗策略等方面仍存在诸多争议和未明之处。本文旨在全面梳理并综述DAOD在流行病学特征、发病机制、临床表现、诊断及治疗策略等方面的最新研究进展,以期为临床医生提供更全面、更准确的指导,提升DAOD的诊治水平,降低患者致残率,这一研究具有重要的临床意义和现实价值。
1. 流行病学
登革热是由登革病毒(dengue virus, DENV)引发的一种急性传染病。DENV属于黄病毒科(flaviviridae)的黄病毒属(flavivirus),基因组为 11 kb 的单股正链 RNA,编码 3 种结构蛋白(衣壳蛋白 C、膜蛋白 M、包膜蛋白 E)和 7 种非结构蛋白,即NS1、NS2A、NS2B、NS3、NS4A、NS4B 和 NS5[1]。主要通过受感染的蚊媒叮咬进行传播,其中埃及伊蚊(Aedes aegypti)和白纹伊蚊是最主要的传播媒介。登革热主要流行于东南亚、非洲、西太平洋以及美洲的热带和亚热带地区,影响超过100个国家和地区,其中亚洲占了70%。在过去的二十年里,全球登革热发病率明显上升。根据世界卫生组织(World Health Organization,WHO)的数据,从2000年到2019年,报告的病例激增了10倍,从50万例上升到520万例[2]。自2023年以来,登革热持续传播,加上病例意外激增,导致80多个国家或地区报告了500多万例感染病例,其中包括5 000多例与登革热相关的死亡病例[2]。2007—2017年间,全球因登革热导致的死亡人数上升了65.5%,年均死亡人数超过了40 500(95%CI:17 600~49 800)人。学术预测模型显示,全球面临登革热风险的人口比例预计将从2015年的53%增长到2080年的63%[3]。在过去的十年里,我国也经历了一波又一波的登革热疫情。从2013年到2020年,中国337个调查城市共报告了95 339例登革热病例,包括83 318例本土病例和12 021例境外输入病例[4]。在空间分布方面,登革热病例主要分布在中国东南部,特别是胡焕庸线以南。就时间分布而言,中国的登革热每年都有流行高峰,通常在7—11月,其他时间仅报告零星[4]。
DENV的感染可累及全身多个器官系统,其病理影响广泛且复杂。基于患者的临床表现和疾病严重程度,WHO的最新分类标准(2009版)将登革热分为无警示体征的登革热、登革热伴有预警症状和严重登革热[5]。无警示体征的登革热(dengue fever, DF)是登革热的轻症形式,常表现为非特异性的发热和全身症状,病情通常较轻,病程约7 d,患者预后较好。严重登革热(severe dengue)是登革热的危重形式,主要表现为血浆渗漏(休克、胸腔积液)、严重出血、器官衰竭(如肝、心、肾),常威胁生命,病死率为 0.01%~39%[3]。登革热伴有预警症状(dengue with warning signs),这是介于普通型和严重型之间的一种形式,伴有腹部疼痛、持续呕吐、黏膜出血等。提示患者可能进展为严重登革热,需要密切观察和及时干预。
近年来,登革热引起的眼部并发症逐渐受到眼科医师的关注。尽管目前缺乏关于登革相关眼病(dengue-associated ocular diseases, DAOD)发生率的确切统计数据,但已有若干研究指出,在登革热住院患者中,约7.9%~56.7%的病例会出现眼部症状(表1)。其患病率跟登革热的严重程度有关,在登革热患者中有7.1%的患者出现眼部并发症,而在严重登革热患者中有54.5%患者出现眼部并发症[6]。
表1 登革相关眼病的流行病学汇总
Table 1 Summary of the epidemiology of dengue associated ocular diseases
|
年份 |
国家 |
纳入人群数/人 |
DAOD发病人数/人 |
发病率/% |
|
|
1 |
2003[7] |
印度 |
134 |
54 |
40.3 |
|
2 |
2006[6] |
印度 |
1719 |
137 |
7.9 |
|
3 |
2014[8] |
印度 |
120 |
68 |
56.7 |
|
4 |
2016[9] |
马来西亚 |
145 |
65 |
44.8 |
2 发病机制
DENV感染引发的眼病并发症是一个复杂的病理生理过程,包括病毒和宿主等多种因素,如病毒亚型、NS1病毒抗原、宿主的抗DENV NS1抗体和宿主的免疫状态等。电子显微镜观察到登革热患者皮肤毛细血管内皮细胞肿胀[10];严重登革热患者康复期循环内皮细胞增多,且患者体内可溶性黏附分子水平升高[11],提示内皮细胞激活和损伤。内皮细胞损伤导致血管通透性改变致血浆渗漏、血小板减少、凝血功能障碍而出现严重的登革热表现。2.1登革病毒血清型
DENV共有4种不同的血清型(DENV-1至DENV-4),每个血清型内部又存在多种基因型。特定的登革热血清型可能使患者更易患登革相关眼部并发症。尽管感染任何血清型的DENV都可能导致登革热,但有前瞻性研究表明,2型DENV引发登革热的风险最高[12]。然而,就眼部并发症而言,现有证据提示,1型DENV感染似乎更常与眼部并发症相关联。Chee等[13]对2005年与2007年登革热流行期间,因登革热而入院治疗的患者群体中登革热黄斑病变的发病率进行了对比分析。研究结果显示,在2005年的登革热流行期间,登革IgM抗体阳性的患者群体中,有10%的患者发展出登革热相关性黄斑病变;然而,在2007年的流行期间,所有登革IgM抗体阳性的患者均未观察到与登革热相关眼病的出现。同时,研究发现,2005年的登革热疫情主要由1型血清型病毒引起,而2007年的疫情则主要由2型血清型病毒导致。在2020年留尼汪岛登革热流行期间,对出现DAOD的患者进行的血清学检查显示,能够确定血清型的患者占50%,而在这些可确定血清型的病例中,所有患者均感染了1型DENV[14]。
2.2 非结构蛋白1病毒抗原
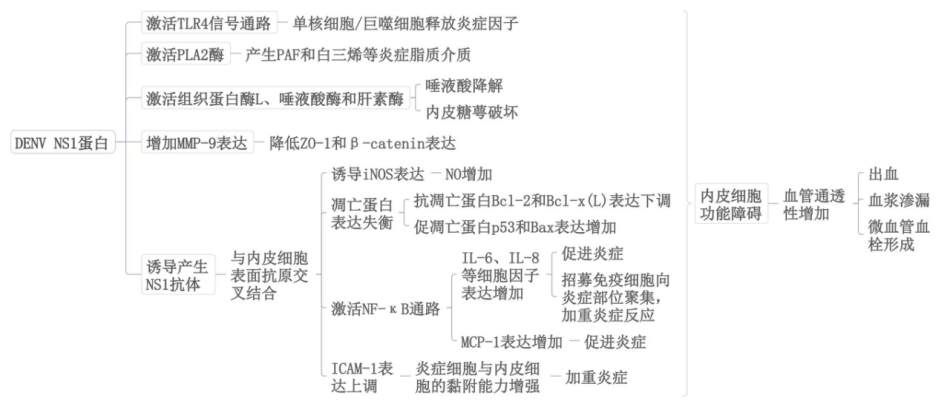
NS1是组成DENV的一种非结构蛋白,是导致严重登革热的关键因素。它也是一种分泌蛋白[15],在疾病的急性期s-NS1水平特别高,这与疾病的严重程度有关。NS1抗原是导致内皮细胞单层完整性破坏的重要因素。1)NS1通过Toll-like receptor 4 (TLR4)信号通路激活外周血单核细胞和巨噬细胞,导致炎症细胞因子释放,从而导致内皮细胞单层完整性的破坏,引起血管渗漏。2)NS1还会激活组织蛋白酶L、唾液酸酶和肝素酶,导致唾液酸降解和内皮糖萼破坏,从而导致内皮功能障碍。3)NS1可激活炎性磷酯酶 A2 (phospholipase A2, PLA2)酶,而这种酶负责产生许多炎性脂质介质,如血小板活化因子(platelet-activating factor,PAF)和白三烯。PAF和白三烯均会介导登革热和许多其他疾病中的血管渗漏。4)NS1会增加基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9) 的表达,随后NS1–MMP-9相互作用会通过降低小带闭合1 (zonula occludens-1, ZO-1)和β-catenin的表达导致内皮功能障碍增加。血管通透性增加导致血浆渗漏,引发视网膜水肿、出血和黄斑病变。视网膜微血管病变可能出现血栓形成、缺血和出血,进一步影响视力。
2.3 抗DENV NS1抗体
NS1具有高度免疫原性,可诱导机体产生抗NS1抗体,抗DENV NS1抗体也是导致严重登革热的关键因素之一[16],抗体依赖增强效应(antibody-dependent enhancement , ADE)可加重病情。这些抗体能与非感染的内皮细胞发生交叉反应,直接结合到内皮细胞表面,引发内皮细胞凋亡和炎症反应[17]。1)抗 NS1 抗体与内皮细胞结合后,通过多种途径诱导细胞凋亡。一方面,它能诱导诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达,促使一氧化氮(nitric oxide, NO)产生,NO的积累可导致细胞凋亡;另一方面,抗NS1抗体处理后,细胞内抗凋亡蛋白Bcl-2和Bcl-x(L)表达下降,而促凋亡蛋白p53和Bax表达增加,这种蛋白表达的改变打破了细胞内的凋亡平衡,促使内皮细胞走向凋亡。2)抗NS1抗体结合内皮细胞会激活核因子κB(nuclear factor kappa B, NF-κB)通路。NF-κB是一种关键的转录因子,被激活后会进入细胞核,调控一系列炎症相关基因的表达,例如IL-6、IL-8和MCP-1等细胞因子表达显著增加。这些细胞因子具有多种生物学活性,IL-6和IL-8是重要的促炎细胞因子,同时可进一步招募免疫细胞,如中性粒细胞、单核细胞等,使其向炎症部位聚集,加重炎症反应。MCP-1则能趋化单核细胞,进一步扩大炎症细胞群体,加重炎症损伤。抑制NF-κB通路或用DENV NS1预处理抗体,可抑制细胞因子的上调,这进一步证明了NF-κB通路在抗NS1抗体引发炎症反应中的核心作用。3)抗NS1抗体可促使细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)表达上调。ICAM-1表达增加会使外周血单核细胞与内皮细胞的黏附能力增强。这不仅会导致炎症细胞在血管内皮部位的聚集,还可能通过免疫细胞的活化和释放其他炎症介质,进一步加重炎症反应,对内皮细胞造成持续性损伤。
2.4 血小板数量减少和功能异常
血小板减少是DENV感染的典型血液系统表现。在急性登革热发作期间,眼部症状的高峰期与患者体内血小板计数的最低水平相吻合。血小板数量减少与血小板生成减少和血小板裂解有关。研究表明,DENV感染会抑制骨髓中巨核细胞的生成过程,从而直接导致血小板生成量下降[18]。在体外实验中,抗NS1抗体和登革热患者血清可引起血小板裂解。血小板数量减少后,无法在止血过程中发挥应有的作用,导致机体止血能力下降,增加出血风险[17]。此外,研究表明,抗 NS1抗体能识别血小板上的蛋白二硫键异构酶(protein disulfide isomerase, PDI),这种识别干扰了血小板正常的聚集功能,使血小板难以形成有效的血栓,从而影响止血过程。由于血小板数量减少,血管通透性增加,这进一步恶化了视网膜水肿及血浆渗漏的情况。除此之外,血小板在免疫调节过程中也发挥重要作用,其数量的降低可能加剧炎症反应,对眼部组织造成更严重的损害[19]。
图1 登革病毒NS1蛋白和抗NS1抗体的病理机制示意图
Figure 1 Schematic diagram of the pathological mechanism of dengue virus NS1 protein and anti-NS1 antibody
2.5 免疫介导的炎症反应
多种眼部症状通常在发热后7 d出现,因此推测DENV不是通过直接感染,而是免疫介导来发挥主要作用。DENV通过感染宿主的免疫细胞,导致细胞因子风暴[16]。免疫系统释放大量促炎性细胞因子(如TNF-α、IL-6、IL-8),导致局部炎症反应,进而引起血管通透性增加和血-视网膜屏障破坏。
3 临床表现、诊治和预后
DAOD的临床表现多样,也缺乏明确诊断的金标准。临床工作中通常根据患者全身症状,登革热特异性IgM或 IgG抗体血清学检测,以及眼部具体的症状、临床特征和影像学特征,拟定诊断和予以相应的治疗。表2呈现了不同研究中各类登革热相关性眼部疾病的发生率数据。受纳入标准异质性、地域流行病学特征差异及研究时间跨度等因素影响,各研究结果存在一定的差异。
3.1 结膜下出血
结膜下出血是登革热患者中最为常见的眼前段并发症。研究发现,在登革热住院患者中结膜下出血的发生率为5.17%~92.56%[7-9],多双眼受累。结膜下出血主要表现为两种类型:多发性点状出血和弥漫性出血,根据Kapoor(2006)[7]研究发现这两种出血类型分别占84%和16%。结膜下出血通常具有自限性,可自行消退。鉴于结膜下出血在登革热患者中的高发生率,当临床表现为发热并伴有结膜下出血时,应高度怀疑登革热感染的可能性,尤其是在流行区或者有登革热疫区旅居史的患者。此类症状的出现对于登革热的诊断具有重要的提示作用,有助于早期识别和及时治疗。
表2 各类登革相关眼病的发生率
Table 2 The incidence rate of various dengue-related eye diseases
|
序号 |
年份 |
国家 |
DAOD人数/眼数 |
各类眼病发生人数/眼数 |
占比 |
|
1 |
2003[7] |
印度 |
54人 |
结膜下出血: 50人 视网膜浅层出血: 3人 硬性渗出: 2人 棉绒斑: 3人 视网膜血管扩张迂曲:2人 |
92.56% 5.55% 3.7% 5.55% 3.7%
|
|
2 |
2003—2004[20] |
新加坡 |
13人 |
黄斑水肿: 10人 黄斑出血: 9人 视网膜血管炎: 3人 血管炎伴网脱: 1人 葡萄膜炎: 1人 |
76.92% 69.23% 23.07% 7.69% 7.69%
|
|
3 |
2006[21] |
新加坡 |
65眼 |
结膜下出血: 3眼 前葡萄膜炎: 5眼 中间葡萄膜炎: 8眼 后葡萄膜炎: 7眼 视盘水肿: 2眼 视网膜血管炎: 15眼 视神经炎: 1眼 黄斑出血: 45眼 黄斑水肿: 50眼 |
4.6% 7.7% 12.3% 10.8% 3.1% 23.1% 1.5% 69.2% 76.9%
|
|
4 |
2014[8] |
印度 |
68人 |
结膜下出血: 55人 结膜水肿: 10人 前葡萄膜炎: 6人 周边视网膜出血: 14人 硬性渗出: 9人 棉绒斑: 2人 视网膜血管炎: 3人 视神经炎: 1人 |
80.88% 14.70% 8.82% 20.58% 13.23% 2.94% 4.41% 1.47%
|
|
5 |
2020[14] |
留尼汪岛 |
28人 |
葡萄膜炎: 6人 视网膜出血: 3人 棉绒斑: 3人 黄斑病变: 18人 |
21.4% 10.7% 10.7% 64.2% |
3.2 葡萄膜炎
登革热相关性葡萄膜炎属于少见病症,其中又以前葡萄膜炎为主[6, 20, 22]。在DENV所致眼部疾病的患者群体中,前葡萄膜炎的发生率介于4.8%~17%。此类患者的临床症状主要包括视力减退、结膜充血及眼部疼痛,且通常影响双眼,但并非所有病例均为双眼同时发病。体征可观察到睫状充血、前房细胞,以及角膜后沉着物(keratic precipitates,KP)。KP的形态大小各异,从细微至显著不等。在一些严重的情况下,前房可能出现纤维蛋白渗出膜[23]。此外,少数病例还伴随有眼内压升高的情况。登革相关中间葡萄膜炎在临床文献中较少被单独描述,通常作为全葡萄膜炎的一部分或与眼底病变共存。Bacsal等[24]报道,在41例以登革相关黄斑病变为主要特征的患者群体中,观察到31%的病例伴有玻璃体内细胞浸润现象,而11%的患者则同时表现出前房和玻璃体内的细胞浸润。这一发现提示中间葡萄膜炎可能在某些眼底疾病,特别是黄斑病变中扮演着重要的角色,并且可能是这些复杂眼部病症的一个重要组成部分。上述研究提示,在评估黄斑病变患者时对中间葡萄膜炎进行详细检查,有助于更全面地理解患者的病理状态并指导治疗。
葡萄膜炎的发生时间与急性登革热感染之间的关系较为复杂。通常情况下,葡萄膜炎可在发热等急性症状出现后的数周内发生。然而也有报道指出,部分患者在急性登革热期间并未表现出葡萄膜炎的症状,而是在感染后3~5个月,当全身性症状已经完全消退之后,才首次出现葡萄膜炎的表现[6],。这种延迟性的发病模式提示,即使在急性期过后,DENV感染仍可能对眼部组织产生迟发性的免疫反应或炎症影响,因此对于曾经有登革热的患者,即便是在恢复期,也应保持对眼部健康状况的警惕,并进行适当的随访观察。
治疗应遵循葡萄膜炎的标准管理原则,包括局部应用糖皮质激素以减轻炎症反应、使用睫状肌麻痹剂缓解眼部痉挛以及必要时采用降眼压药物控制眼内压。对于存在眼后段受累的病例,可能需要口服糖皮质激素来更有效地控制全身性炎症。通过上述综合治疗措施,大多数患者的视力有望恢复或接近发病前的水平。然而,具体的治疗方案应根据患者的具体病情和个体差异进行调整,以确保最佳的治疗效果和安全性。此外,定期随访监测对于评估治疗反应和调整治疗策略至关重要。
3.3 黄斑病变
黄斑病变是DENV感染中最常见的严重眼部并发症。2006年的一项横断面研究,针对新加坡登革热流行期间血清阳性的住院患者,估计黄斑病变的患病率为10%[25]。2016年在马来西亚进行的类似研究发现,5.5%的登革热住院患者出现了黄斑病变[9]。而在专门针对DAOD的研究中,黄斑病变的发生率最高,介于64.2%~76.9%之间[14, 20]。黄斑病变通常在发热后的7~10 d内发病。患者最常见的主诉包括突然视力下降、中心暗点和飞蚊症。根据病变的严重程度不同,视力可从正常到指数不等。眼底检查可见黄斑出血、黄斑水肿、囊性改变以及黄白色点状改变。黄斑出血以点状出血为主[20]。这些体征在临床上具有重要的诊断意义。
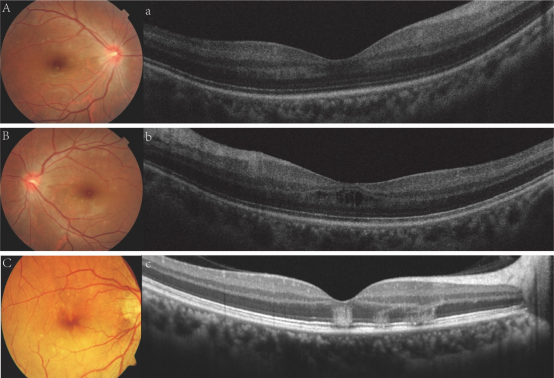
Teoh等[26]基于时域光学相干断层扫描(time-domain optical coherence tomography, TD-OCT)将登革相关黄斑病变分为3种类型(表3和图1)。
随着SD-OCT的应用,发现3型就是急性黄斑视网膜病变(acute macular neuroretinopathy,AMN)[27,28]。AMN是一种罕见的黄斑病变[29],其特征为突然出现中心暗点,伴有楔形深红棕色黄斑病变,更常见于年轻女性。它与多种因素相关,如病毒性疾病、口服避孕药、创伤、夜间低血压、咖啡因使用、肾上腺素和去甲肾上腺素注射等。DENV感染也被认为是AMN的一个潜在诱因。在2015年中国华南地区的登革热流行期间[27],55.6%的黄斑病变患者被诊断为AMN。这类患者的眼底外观可能是正常的,或在黄斑区出现楔形或斑片状病变,呈黄白色或褐色。荧光素眼底血管造影(fluorescein fundus angiography , FFA)和自发荧光检查结果通常是正常的,但在红外线照片中可见黄斑区局部暗点;SD-OCT显示黄斑区从Helen纤维层到椭圆体带的高反射,导致正常结构反射中断。OCTA 检查发现毛细血管血流不足、中心凹无血管区扩大以及浅层和深部毛细血管丛中毛细血管的丢失[30]。这些特征提示可能出现视网膜血管微闭塞。
对于大多数轻度病例,可以采取以观察随访为主的保守治疗策略。对于病情较重的患者,可给予局部使用糖皮质激素、口服糖皮质激素[0.5~1 mg/(kg•d)]或冲击治疗[20, 31-32],甚至使用静脉注射免疫球蛋白[33]。
尽管大多数患者的视力在治疗后得到显著改善,但部分患者可能会遗留持续的中心暗点。Teoh等[26]的研究表明,在2年的随访期内,1型黄斑病变中有30.3%、2型中有56.3%、3型中则有100%的患者存在中心暗点(表3)。OCT检查显示,这些患者的强反射病灶会逐渐消退,但外核层可能出现不可逆的变薄[27]。
黄斑病变与登革热的严重程度密切相关。Teh等[9]的研究表明,重症登革热患者发生黄斑病变的风险增加了4倍。因此,对于严重登革热患者,建议及时进行眼科会诊,并通过OCT等影像学方法排除黄斑病变的可能性,以确保早期诊断和适当管理。
表3 登革相关黄斑病变的分型、OCT特点和中心暗点
Table 3 Classification, OCT characteristics and scotoma of dengue-associated macular degeneration
|
黄斑区OCT特点 |
占比 |
中心暗点占比 |
残留中心暗点占比 |
|
|
1型 |
44.6% |
81.8% |
30.3% |
|
|
2型 |
黄斑囊样水肿 |
21.6% |
100% |
56.3% |
|
3型 |
局部从Helen纤维层到椭圆体带的高反射,使正常结构反射中断 |
33.7% |
100% |
100% |
图2 登革相关黄斑病变OCT分型
Figure 2 OCT classification of dengue-related macular degeneration
3.4 视神经炎
在登革热的急性期,脑炎、脑病、脑膜炎以及脊髓炎是最为常见的神经系统并发症。登革热视神经炎的发病率较低,低于1.5%[21],且常与登革相关黄斑病变并发[24, 34]。患者通常在发热后1周至1个月内出现视力下降的症状[35-39],可能表现为单眼发病或双眼先后发病。患者视力显著下降,范围从0.5到无光感不等,并可能伴或不伴有眼部疼痛。眼前节检查未见明显异常。瞳孔对光反射可表现为正常,但也可能出现瞳孔散大[35],并伴有或不伴有相对性瞳孔传入障碍(relative afferent pupillary defect,RAPD)。眼底检查可见视盘水肿充血,边界模糊。磁共振成像(magnetic resonance imaging, MRI)检查结果可能正常,但也有病例显示眶内段和颅内段视神经增粗[36]。首选治疗方法为全身性糖皮质激素冲击疗法,随后转为口服糖皮质激素并逐渐减量。大多数患者经过系统治疗后,视力能够得到有效恢复,甚至恢复到正常水平。然而,也有部分病例报告指出,尽管接受了治疗,患者的视力仍未见任何改善[36]。
3.5 视网膜血管病变-血管炎/血管阻塞
登革相关视网膜血管病变较为罕见,文献以个案报道为主[40-44]。根据Chan等[20]的一项回顾性研究,在13例出现DAOD的患者中,有4例确诊为视网膜血管炎。这些患者通常在登革热全身症状出现后的7~10 d内突然出现双眼视力急剧下降,从指数至0.025不等。裂隙灯检查未发现眼前段明显异常。眼底检查显示后极部黄斑区中心凹周围存在出血,并伴有散在的棉绒斑。OCT揭示了黄斑囊样水肿的存在。FFA则显示出视盘和后极部血管的渗漏,动脉和静脉均可能累及。此外,视网膜血管炎还可能伴随其他并发症,如玻璃体炎[24]、视网膜缺血、血管阻塞或渗出性视网膜脱离[20]。
治疗主要依赖于糖皮质激素,根据病情严重程度给予口服(1 mg/kg)或静脉滴注冲击。对于部分患者来说,这种治疗方法能够带来良好的预后[41];然而,也有一部分患者的视力未能得到显著改善[40],这可能与黄斑区缺血有关。因此,早期诊断和及时治疗对于改善患者的视力预后至关重要。同时,针对伴发的并发症,可能需要采取额外的治疗措施,以全面管理病情并提高治疗效果。
3.6 Purtscher样视网膜病变
Purtscher视网膜病变是一种微血管闭塞性疾病,通常与颅脑或胸部创伤以及长骨骨折相关。此外,也可由非创伤性疾病引起,如急性胰腺炎、肾衰竭和自身免疫性疾病等导致Purtscher样视网膜病变。DENV感染也可能是该病的一种潜在诱因。Lima等[45]报道2例相关病例。2例患者均在发热后10 d突然出现双眼视力急剧下降,从指数至0.6不等,且双眼受累。1例患者前房可见少量细胞,其余裂隙灯检查未见异常。眼底检查发现,后极部、赤道部及视盘鼻侧存在弥漫性的Purtscher样棉绒斑,并伴有少量出血。OCT显示视网膜内层出现高反射信号,这些信号与眼底照片中的棉绒斑相对应;同时黄斑区可见视网膜下液体积聚或囊样水肿。未经特殊治疗的情况下,在45 d ~ 4个月的随访期内,患者的视力逐渐恢复,部分甚至恢复到1.0。眼底的棉绒斑和出血完全消退,但在OCT检查中仍可见残留的视网膜内层高反射。此病例提示,即使在未接受特定治疗的情况下,Purtscher样视网膜病变可表现出一定的自限性,但其长期影响仍需进一步观察和研究。
3.7 其他
此外,DENV感染也可能累及眼外肌,出现复视,双侧水平凝视麻痹[36]。在卫生条件较差的地区,可能并发角膜炎、角膜穿孔,甚至感染性眼内炎等[46-47]。
4 登革热治疗新进展
登革热可能引发多种并发症,严重时会危及生命,但目前尚无特效治疗药物,主要依赖支持性治疗缓解症状和预防并发症。
4.1 液体疗法
对于登革热患者,在降温的同时要及时补充水分。一般情况下,症状较轻的患者通过口服补液,即可维持身体的水盐平衡,满足身体对水分的需求。而对于病情严重的患者,如出现休克风险的患者,静脉补液能够快速补充患者体内流失的液体,维持血液循环的稳定,有效预防休克现象的发生,降低患者的死亡风险。
4.2 出血处理
严重登革热可能导致患者出现严重出血症状,威胁生命安全。在治疗过程中,会采用多种方法来处理出血问题。例如,血小板输注可以增加患者血液中的血小板数量,增强凝血功能,减少出血;重组人白细胞介素-11疗法,能够促进血小板的生成,加速止血过程,对控制出血症状具有一定的效果。针对DENV,研究人员开展了大量工作,对众多合成药物和植物化学提取物进行了体外和体内研究评估,部分化合物在抑制登革热方面展现出了显著效果。不过,截至目前,市场上仍没有获得美国药品监督管理局(food and drug administration, FDA)批准的专门用于治疗登革热的药物[48]。
4.3 针对不同病毒蛋白的合成药物
以病毒或宿主成分作为靶点的多种潜在抗登革热治疗方法已进入临床试验阶段。例如,口服泼尼松龙作为抗炎剂,洛伐他汀在内皮细胞中既发挥抗DENV作用,又具有抗炎特性。还有针对不同病毒蛋白的抑制剂,NS1蛋白酶抑制剂包括肽3、4、10和11等,它们有望干扰NS1的功能;NS3解旋酶抑制剂如伊维菌素、ST-610和苏拉明,通过作用于该关键酶来破坏病毒复制;NS2B-NS3蛋白酶复合体则受到抗菌肽(如protegrin-1和retrocyclin-1)以及小分子化合物(如奈非那韦、肌肽、巴马汀和新型合成剂)的靶向作用;NS4B蛋白酶抑制剂,如JNJ-1802、JNJ-A07、NITD 618、SDM25N、AM404和NITD-688等,能够破坏病毒复制复合体的形成;包膜蛋白酶抑制剂,如1662G07、DN59、NITD488和格尼他林等,可阻止病毒附着和进入宿主细胞;此外,膜蛋白可被MLH40靶向,衣壳蛋白能被VGTI-A3、VGTI-A3-03和ST-148等化合物作用。另外,嘧啶类似物(如3e和3h)在体外细胞培养试验中,对4种已知的DENV毒株表现出了强大的抑制活性。
4.4 植物提取物
多种植物提取物显示出抗登革热的潜力。例如,印楝(azadirachta indica)叶提取物能抑制2型DENV的复制,还可提高血小板和总白细胞计数;柠檬草(cymbopogon citratus)根提取物中的香叶醇能抑制DENV-2在体外的复制;胡颓子(hippophae rhamnoides)叶提取物可有效抑制DENV在细胞中的复制,并调节人体炎症细胞因子的产生。鉴于DAOD,特别是眼底病变可能对患者视功能造成严重损害,研究者迫切希望针对DENV开发的合成药物以及通过植物化学提取技术获得的有效成分,能够在临床实践中成功应用。这一成果不仅有望为患者提供更有效的治疗选择,更将为DAOD的治疗领域带来新的希望。