角膜移植手术后眼表微环境与干眼的研究进展
关键词
摘要
我国有 300余万名角膜盲患者,角膜盲是我国第 2 位致盲性眼病,角膜移植术通过将病变或损伤的角膜组织替换为健康的供体组织,以重建角膜的功能和透明性,从而有效提高患者的视力。干眼症作为角膜移植术后最为常见的并发症,已成为影响手术预后效果的关键因素,术后干眼症的高发性及其对角膜移植片存活率的负面影响,已成为眼科领域亟待解决的临床难题。这一并发症的形成源于手术对眼表结构的破坏、药物干预及术后修复过程中多重因素的协同作用,导致眼表微环境失衡。术后干眼症除了会引起眼部干涩感、异物感等症状外,还可能造成浅层点状角膜炎和角膜上皮反复剥脱,且眼部长期的炎症反应也会造成角膜内皮细胞的损伤,从而影响视功能,甚至造成手术失败,但由于其他并发症相对多见且更为严重,术后干眼并未得到足够重视。因此,本文系统阐述角膜移植术后眼表微环境失衡与干眼症的相互作用网络,探讨其发病机制、治疗措施,为优化围手术期管理、提升植片长期存活率提供理论依据与临床实践指导。
全文
文章亮点
1 关键发现
• 系统构建角膜移植术后干眼“神经损伤-炎症-泪膜失衡-腺体功能障碍-微生态失衡”多维交互、恶性循环的病理网络。
• 引入新兴治疗策略在逆转眼表微生态失衡、改善干眼方面的转化潜力。
2 已知与发现
• 突破了单一机制研究局限,首次整合微生态失衡与手术创伤、药物毒性等多重因素的协同作用。
• 揭示微生态失衡通过干扰泪膜合成、抑制上皮修复加剧干眼,补充术中光毒性、术后眼睑卫生限制等破坏因素。
• 为自体血清、神经修复等策略提供微生态调控相关理论支撑,衔接基础研究与临床应用。
3 意义与改变
• 推动术后管理从“植片中心”转向“眼表功能重建”综合管理范式。
• 提升临床对微生态失衡的重视,优化综合防治策略,助力提高植片存活率与患者生活质量。
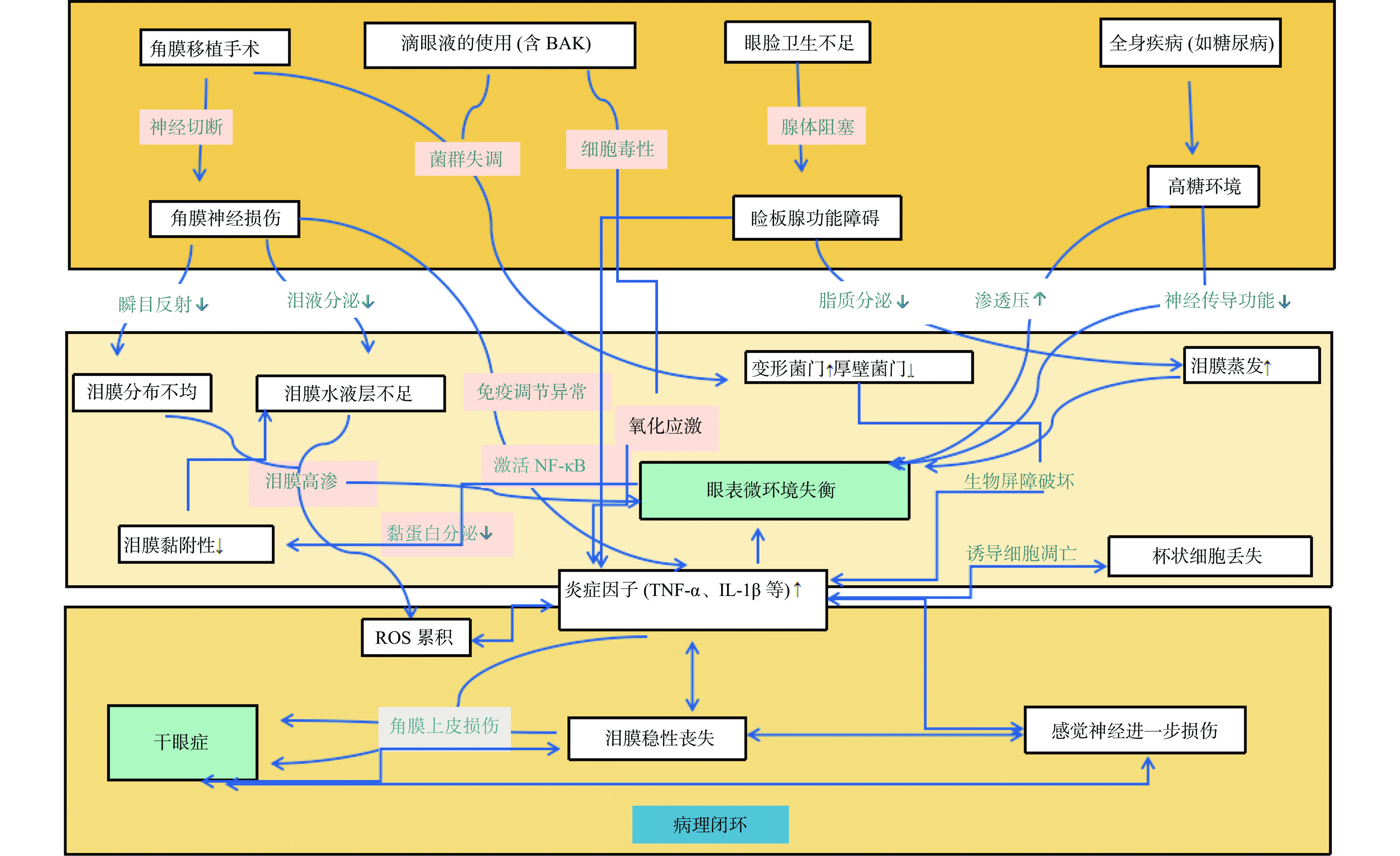
角膜移植术(keratoplasty)是将病变或损伤的角膜组织替换为健康的供体组织,以重建角膜的功能和透明性,从而有效提高患者的视力[1]。在角膜移植手术中,眼表受到微环境的稳态对手术预后至关重要。眼表是由眼表组织(角膜上皮、角膜缘干细胞、结膜、眼睑)与泪液分泌装置(主副泪腺、睑板腺、结膜杯状细胞及上皮细胞)共同构成的功能单元,这些组分通过神经信号传导、激素和微生物相互作用,共同维持眼部微环境的动态平衡[2-3]。这一平衡一旦被打破,将引发眼表功能紊乱,增加术后并发症风险。其中,干眼症(dry eye disease, DED)为术后常见的并发症。DED又称角结膜干燥症,是由多重因素引发泪液品质和动力学的紊乱,导致泪膜稳定性削弱,并伴随眼部不适或眼表组织异常的一类眼病统称[4]。角膜移植术后泪膜和眼表受各种损伤破坏,泪膜不稳定引发的DED反过来损害了视觉功能和眼表完整性[5] ,不仅降低移植后的患者的生活质量,还有可能导致手术失败。本文旨在系统梳理角膜移植术后干眼与眼表微环境失衡的相互作用网络,探讨其多因素发病路径与综合治疗策略,优化围手术期管理、提升植片长期存活率及改善患者生活质量提供理论依据与临床参考。
1 发病机制
1.1 眼部神经损伤
角膜是人体最敏感的结构之一。角膜神经通过调节泪液分泌和保护性反射,为上皮细胞和基质细胞提供营养支持,维持角膜的透明度,促进角膜健康[6]。人类角膜由神经纤维密集供应,其中大部分是感觉神经,主要来源于三叉神经的眼支,以径向平行的方式进入周围角膜,然后穿过前弹力层形成角膜基底下神经丛(sub-basal nerve plexus, SBNP),其游离(无髓鞘)神经末梢终止于角膜上皮构成角膜的最外层,保护角膜免受微生物侵袭[7]。通过控制含有水、电解质和各种蛋白质的泪膜水层的泪腺分泌,眼部神经调节在维持泪液体积和组成方面发挥着不可或缺的作用[4]。在正常的动态平衡状态下,角膜与结膜神经传来的微弱感知信号会被送至大脑中的泪核,随后这些刺激会激活面神经(颅神经 Ⅶ)的交感与副交感传出神经纤维,以支配泪腺释放足够的泪液,形成泪膜保护层来覆盖眼表[8]。三叉神经末梢中有一个特殊性质的感受器——冷受体,位于角膜表面,温度变化、泪液蒸发以及由此引发的眼表干燥和高渗泪液能够激活冷受体,控制眨眼频率和泪液分泌[9]。此外,角膜和眼睛周围结构的自主神经支配参与调节杯状细胞、泪腺和睑板腺分泌的各种泪膜成分[10]。泪液分泌主要由副交感神经系统控制,乙酰胆碱(acetyl choline, ACh)和血管活性肠肽(vasoactive intestinal peptide, VIP)等神经递质刺激副交感神经系统激活细胞内信号通路和离子通道[11]。角膜神经去支配抑制磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶 B (protein kinase B, Akt)、Janus 激酶(janus kinase, JAK)/信号转导及转录激活因子(signal transducer and activator of transcription, STAT)等关键信号通路,泪腺细胞生长、发育、分化和凋亡的分子机制受损 ,进而削弱组织修复能力和维持正常功能的能力[12]。Li等[12]研究发现,角膜磨损导致上泌涎核(superior salivatory nucleus, SSN)中c-Fos+细胞的数量减少 30.54%。免疫失调在角膜神经损伤后的泪腺功能障碍中也起着重要作用,其Toll样受体信号传导(toll-like receptor signaling, TLR)、核苷酸结合寡聚化结构域样受体信号传导(NOD-like receptor signaling, NLR)、T 细胞受体信号传导等关键免疫相关途径显著下调,表明神经损伤会改变泪腺的先天性和适应性免疫反应。CD4+T 细胞、CD8+T 细胞、NK 细胞和 γδT 细胞等免疫细胞亚群显著减少,这些细胞对维持免疫监视和腺体稳态至关重要 [13]。角膜移植手术中,会较大范围地切断供体和受体角膜中的上皮下神经丛和基质神经,导致SBNP的异常[14]。一方面角膜知觉减退,反射性泪液分泌减少,另一方面使瞬目频率下降,眼表暴露时间增加,泪液蒸发过强,同时瞬目减少,还可使睑脂酶排放减少,加速泪液蒸发。角膜神经横断,瓦勒变性(wallerian degeneration, WD)通过轴突支架缺失激活施万细胞(schwann, SC),使其去分化为修复型施万细胞,进而分泌炎症因子,招募中性粒细胞/巨噬细胞,导致角膜持续性炎症 [15]。副交感神经末梢将ACh(主要神经递质)释放到突触间隙中,与效应细胞上的毒蕈碱胆碱能受体 (muscarinic 3 Acetylcholine Receptor, M3AChR) 结合以触发下游信号级联反应,调控细胞生理功能。炎症因子会抑制ACh从神经末梢释放和自身抗体阻断 M3AChR,从而干扰神经元刺激向眼表微环境分泌成分的传递[16]。 尽管周围神经具有再生能力,但角膜神经再生通常缓慢且不完全,导致长期神经功能障碍和相关并发症[17]。神经纤维的生长需要穿越手术切口处的瘢痕组织,这进一步阻碍了神经的恢复[18]。同时,新移植的角膜与周围组织的整合也需要时间,这可能会影响神经的正常生长和功能恢复。接英等[19] 应用共聚焦显微镜观察穿透性角膜移植术后植片神经再生情况。结果显示,术后1个月,植片上未观察到任何神经形态,随着术后时间的延长,植片神经开始再生,但再生的神经在形态和密度上仍达不到正常人水平。角膜新生血管(corneal neovascularization, CNV)是角膜损伤及移植后的常见病理改变。研究证实交感神经系统(sympathetic nervous system, SNS)激活及其神经递质去甲肾上腺素(norepinephrine, NE)的释放与角膜碱烧伤、感染及CNV形成密切相关[20-21]。作为SNS主要神经递质,NE主要通过α/β-肾上腺素受体(adrenergic receptors, ARs)发挥作用,NE与β2-AR结合后激活刺激性G蛋白,触发丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、信号转导和转录激活因子3 (signal transducer and activator of transcription 3, STAT3)及核因子 κB(nuclear factor kappa B, NF-κB)等通路,这些通路通过级联反应激活炎症性基质金属蛋白酶和促凋亡因子的编码基因转录[22]。
1.2 睑板腺功能障碍
睑板腺位于上下眼睑的睑板内,含有丰富的腺体,这些腺体通过向眼表分泌脂质(睑脂),在防止泪膜蒸发方面发挥关键保护作用。当腺体分泌功能异常时,可改变泪膜构成,继而引发眼部刺激感、异物感、充血及炎症等症状[23]。手术创伤、眼睑开睑器使用及术后局部用药会影响睑板的功能,产生炎症反应[24]。角膜移植术后,睑板腺功能改变的原因是多因素的,确切的潜在机制尚不清楚。睑板腺被密集的胆碱能副交感神经纤维包绕,这些神经纤维与睑板腺细胞之间存在复杂的信号交互[25]。国外研究发现,永生化人类睑板腺上皮细胞转录和翻译VIP和毒蕈碱乙酰胆碱(muscarinic acetylcholine receptor, mACh)受体,并且相应的受体配体激活腺苷酸环化酶途径,增加细胞内Ca2+和(或)刺激细胞增殖,维持泪膜脂质层和泪膜健康[26]。角膜移植术导致角膜的去神经支配会干扰泪腺功能单位的反馈回路[27] ,因此角膜移植术后睑板腺神经失调可能导致睑脂分泌异常。眼睑卫生不足可能是导致睑板腺功能恶化的另一个原因。充分清洁眼睑,可有效减少睑缘内的脂质代谢产物以及脂肪降解菌数量,有助于抑制眼表 基质金属蛋白酶-9 (matrix metalloproteinase-9, MMP-9) 活性,并改善脂质层质量,以此减轻睑板腺功能异常[28] 。角膜移植术后,为了减少对眼表造成机械损伤的风险,通常不鼓励患者清洁眼睑,缺乏眼睑卫生会导致脂质停滞和腺体阻塞,加重DED。术后部分患者眼压升高,抗青光眼药物会引起亚临床炎症,导致睑板腺角化,随后睑脂停滞[29] 。Lee等 [30]证明,使用含防腐剂的抗青光眼药物的患者睑缘异常、睑脂表达和睑板评分恶化。综上所述,角膜移植术后睑板腺功能障碍的机制可能涉及各种损伤,包括睑板腺神经调节受损、眼睑卫生不足、含防腐剂抗青光眼药物的使用。
1.3 手术相关的炎性反应
炎症反应发生时,中性粒细胞和巨噬细胞的募集以及自由基、蛋白水解酶和环氧合酶的产生,被认为是DED发展的关键因素[31]。辅助性T细胞1型 (T helper 1 cells, Th 1)细胞分泌的γ-干扰素(interferon-gamma, IFN-γ)通过介导上皮细胞凋亡、杯状细胞丢失及鳞状上皮化生参与DED眼表损伤;Th17细胞则通过释放白细胞介素 (interleukin, IL)-17A、IL-17F、IL-22等细胞因子,上调MMP-3、MMP-9表达,直接破坏角膜屏障功能[32]。组织损伤后,循环系统中的单核细胞募集浸润至病变区,分化为经典激活型(M1)巨噬细胞。该亚型高表达一系列肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、IL-1α、IL-1β等促炎介质,直接诱导眼表细胞损伤,并刺激神经末梢引发眼部不适症状[33]。炎症通过破坏泪腺生物节律与神经调控,对泪膜稳态产生多维度损害。泪腺细胞在炎症因子的作用下,水液分泌相关基因的表达会发生改变,CD4+T细胞浸润泪腺导管,腺泡萎缩,水液层分泌功能衰竭。TNF-α、IL-1β等炎性因子抑制黏蛋白5AC基因表达,减少黏蛋白分泌,泪膜亲水性下降;且活性氧(reactive oxygen species, ROS)氧化修饰黏蛋白糖链,破坏其空间构象,致使黏蛋白功能受损,泪膜铺展功能障碍[12]。高渗环境下,眼表细胞受到更强刺激,炎症现象亦会逐渐恶化[34] 。高渗环境通过刺激角膜上皮细胞瞬时受体电位TRPC1(transient Receptor Potential Canonical 1)及机械力敏感通道,触发钙离子内流,直接激活NF-κB/p38 MAPK信号通路,上调TNF-α、IL-1β等促炎因子及MMP-9表达,角膜上皮紧密连接遭到破坏[35-37];同时,高渗等应激源诱导线粒体功能障碍,致使ROS爆发性累积并突破内源性抗氧化防御,ROS 水平升高首先激活NF-κB,导致磷酸化并上调IL-1β和IL-18 的表达,炎症通过释放炎症介质加剧氧化应激[38],过量ROS通过脂质过氧化和蛋白质氧化修饰进一步激活NF-κB/p38 MAPK信号通路[39]。线粒体-内质网凋亡通路被激活,诱导角膜上皮细胞凋亡及杯状细胞丢失,致使黏蛋白分泌锐减[37]。泪膜高渗状态与氧化应激水平相互影响,形成 “高渗→氧化应激→炎症→组织损伤→泪膜失衡→高渗加重” 的自我延续性病理闭环,最终导致泪膜稳定性彻底丧失。King等[40]发现,角膜移植术后,排斥反应期间移植物内 Th1 型细胞因子(IL-2、IFN-γ、IL-12 p40)、Th2 型细胞因子(IL-4、IL-5、IL-6、IL-10、IL-13)以及 Th3型抗炎细胞因子(TGF-β1/2 和 IL-1RA)的 mRNA 表达增加。眼表的炎性反应不仅会破坏局部感觉神经纤维,还会进一步影响角膜神经,降低角膜对刺激的敏感度,从而减少反射活动,并使泪液蒸发加快以及泪腺功能失去稳定[41]。
1.4 泪膜稳定性改变
泪膜不稳定影响眼表上皮结构和功能,是DED主要病因。角膜移植术中需用环钻获得适宜的植片大小,这或许会影响角膜原先的弧度,使其变得更加平坦或更为陡峭。与此同时,植床与植床界面的微观结构特征(包括愈合过程中形成的纤维血管性结合突起)以及生物相容性缝线材料的物理存在,共同重塑了眼表液体-固体界面的张力特性。这种多因素诱导的界面力学改变,通过干扰泪膜-角膜上皮间的流体力学相互作用,最终导致泪膜流体力学分布模式发生病理性重构[42] 。正常的泪膜可划分为3层,分别是最内侧的黏蛋白、中间的水液层以及最外层的脂质层。其中,黏蛋白层在维持整体泪膜功能方面起着不可或缺的作用。在眼表,黏蛋白由结膜杯状细胞和泪腺分泌,也在角膜鳞状上皮和结膜上皮的顶端表达[43] 。有研究发现,角膜移植术完成后,结膜上皮内的杯状细胞在数目、形态及功能方面均随之发生改变;一旦出现移植后急性免疫排斥,则杯状细胞数量会进一步减少;同时手术因素,如手持注射器针管给角膜补充生理盐水时对角膜有一定的冲击力,对眼表上皮产生的物理损害,会进一步诱发角膜水肿,继而延缓角膜修复速度,并削弱黏蛋白的附着能力[44]。若泪液中黏蛋白的分泌出现紊乱,泪膜的稳定性便会下降,同时泪液蒸发速率提高,并伴随渗透压上升。由此不仅会引发上皮细胞的炎性反应,还会进一步加重渗透压的变化,让原本正常的眼表环境难以维系[45] 。角膜移植通常需要1~3 h,手术期间过度光照可能是手术后DED的致病因素。Hwang等[46]通过研究发现,术中显微镜的光使用对兔眼表和泪膜具有毒性作用,表现为房水泪液产生减少、角膜和结膜上皮细胞失活、结膜上皮细胞鳞状化生、结膜杯状细胞密度降低、黏蛋白 5AC 表达降低、角膜和结膜组织的超微结构细胞损伤,以及泪液中IL-1β 表达增加,且这些变化似乎随着光线强度的增加而加剧 。局部使用眼部麻醉剂会减少泪液分泌并降低角膜敏感度,导致瞬目反射次数减少,使泪膜在眼表的分布不均,最终诱发DED[47] 。
1.5 滴眼液的使用
需要进行角膜移植术的患者,在术前、术后都需要用多种滴眼液,而在用于治疗各种眼部疾病的局部眼科药物的配方中,防腐剂起着关键作用[48] ,它可以提供抗菌活性以维持无菌性,从而经济高效地延长保质期[49] 。其中,苯扎氯铵 (benzalkonium chloride, BAK) 是最常用的防腐剂成分。BAK通过剂量依赖性细胞毒性损害角膜上皮稳态,其暴露导致角膜上皮细胞及角膜缘干细胞(limbal epithelial stem cell, LESC)活力下降、形态改变、诱导细胞凋亡,表现为B细胞淋巴瘤因子2 (B-cell lymphoma 2, BCL2)下调,BCL2相关X蛋白(BCL2-associated X protein, BAX)、半胱天冬酶-3(caspase 3, CASP3)、半胱天冬酶-7(caspase 7, CASP7)上调和氧化应激,并显著抑制LESC的增殖、迁移及集落形成能力,导致LESC周期失调[50];同时激活NF-κB和NOD样受体热蛋白结构域相关蛋白3 (NOD-, LRR-and pyrin domain-containing protein 3, NLRP3)炎性小体通路,促进促炎因子(如IL-1β、TN-Fα)释放,加剧眼表炎症[51]。BAK诱导的细胞凋亡、干细胞功能抑制及持续性炎症反应相互作用,共同破坏角膜上皮屏障与修复能力,扰乱眼表微环境,形成DED的恶性循环。Kim等[52]通过研究动物模型发现,BAK 导致角膜上皮细胞损伤,使角膜伤口愈合延迟、结膜杯状细胞丢失,还可诱导结膜上皮和基质的淋巴细胞浸润 ,并增加眼组织中炎症标志物的水平[53],糖皮质激素及免疫抑制药物会增强角膜上皮细胞内蛋白裂解的速度,并对泪膜脂质及黏蛋白结构造成干扰,最终破坏泪膜的平衡状态[54]。
1.6 全身健康因素
Xun等[55]研究结果显示,糖尿病可显著提高角膜移植后并发DED的可能性。由于患者体内长期维持高糖水平,眼部因此处于渗透压偏高的环境,进而增加了DED形成的风险。当泪液处于高渗环境时, MAPK与NF-κB信号级联的磷酸化被激活,触发眼表上皮细胞的应激响应程序,从而引发炎症级联反应[56]。高渗透压下, IFN-γ水平升高。值得注意的是,当机体长期暴露于高糖微环境时,末梢神经纤维的传导功能受到抑制,角膜感觉神经的功能完整性受损。这种神经病变不仅中断了泪液分泌反射弧的传入神经通路,还通过下调神经营养因子的表达水平,削弱了三叉神经对角膜组织的营养支持网络,最终导致泪液分泌减少。与此同时,过高的糖浓度会破坏角膜上皮的屏障特性,引发杯状细胞数量减少,使得眼表的亲水能力随之下降[57] 。高血糖还可触发多元醇途径,细胞内山梨糖醇的积累会导致细胞水肿和功能障碍,最终导致泪腺(lacrimal gland, LG)功能障碍和泪液分泌减少[58]。Asiedu等[59]的研究报告发现,与健康人相比,糖尿病患者的角膜神经纤维及其分支在密度和长度方面均出现显著下降。2型糖尿病患者术前睑板腺形态就发生萎缩、纤维化,甚至脱落和缺失等改变[60],糖尿病患者角膜伤口损伤愈合速度也较正常人明显延迟,加重了DED发生的风险。
1.7 眼表微生态失衡
近年来的研究开始关注眼表微生态在眼部手术后的动态变化及其潜在临床意义。眼表微生物组(ocular surface microbiome, OSM)指定植于眼表(包括结膜、角膜、眼睑及泪液)的微生物群落 [61],与定植于肠道和皮肤的共生菌类似,眼表菌群通过与宿主眼表组织共生共存,诱导局部的免疫耐受,并辅助宿主清除病原微生物[32],在维持眼表健康与生理性稳态中发挥关键作用。这些共生菌通过多重机制参与眼表稳态维持,首先形成生物屏障抵御病原微生物侵袭;其次通过提供肽聚糖等物质增强眼表杀菌能力,激活先天免疫应答;再者,产黏液溶解酶的共生菌参与黏蛋白代谢,强化泪膜的抑菌活性[62]。手术干预、长期使用抗生素等因素可影响眼表微生物群。在一项对 30 例眼睑成形术患者和 23 例对照者的临床病例对照研究中,手术组患者眼中变形菌门显著升高,而厚壁菌门和拟杆菌门显著减少[63]。变形菌门作为眼中潜在的致病菌,可引起结膜炎等多种眼部疾病,并诱发急性和慢性损伤[64],厚壁菌门和拟杆菌门定植的减少损害了正常眼微环境的稳态。目前的研究表明,两者合理的群落比例和定植程度有利于减轻DED患者的症状[65]。16S rRNA 测序结果显示,与对照组相比,手术组病原菌定植显著增加,微生物多样性更高[63]。这表明眼睑成形术可能会扰乱眼黏膜屏障,导致微生物失衡,并可能导致术后眼部不适或功能障碍。因此,眼部微生物群失调可能是影响角膜移植术后DED的重要潜在影响因素。然而,相较于眼睑成形术,角膜移植术对眼表微环境的影响更为复杂且深远,针对角膜移植术后眼表微生态系统性研究仍属于空白领域,未来值得深入探索。
角膜移植术后眼表微环境失衡与DED之间存在多维度、多机制的相互作用,各病理过程相互交织、相互促进[14-15,24,27,31,42,46,50,55,63](图1)。深入理解这些相互作用关系,有助于为DED的治疗提供更全面、更具针对性的策略。
2 术后干眼症评估方法
国际泪膜与眼表学会(Tear Film & Ocular Surface Society, TFOS)及中国专家共识将DED诊断标准定义为症状、体征、泪膜破裂时间(tear film break-up time, BUT)、角膜荧光素钠染色及泪液分泌试验的综合评估,同时辅以量表问卷调查法[66-67]。BUT通过荧光素染色后观察泪膜出现第一个干燥斑的时间,反映泪膜稳定性[68]。角膜移植后12个月内泪膜稳定性下降。这可能由角膜移植手术本身所致,手术中的缝线导致移植物和宿主角膜之间形成了一个脊状结构,不均匀的角膜表面中断了泪膜动力学[69]。角膜荧光染色通过与变性上皮细胞及缺乏黏蛋白覆盖的区域结合,直观显示角膜上皮缺损及泪膜分布异常。然而,现有方法存在显著局限性:裂隙灯光源强度、荧光素钠滴入量、试纸刺激引发的反射性泪液分泌等干扰因素可影响检测结果准确性,且诊断特异性不足[70]。先进的成像技术可更精确地判断。近年来,AS-OCT已被证明是一种非接触式方法,用于评估泪河高度和泪液半月板面积具有高可重复性,并且已被证明对DED的诊断具有高敏感性[71-72]。TFOS将活体共聚焦显微镜(in vivo confocal microscopy, IVCM)列为新兴技术,认为其在DED研究中具有多重应用潜力,有望成为开发验证预测性生物标志物及替代终点的理想工具[73]。Guo等[70]认为,IVCM 诊断 DED 的优势在于可以从细胞水平以非侵入性的方式从细胞水平观察细胞、炎症因子以及神经的数量、形状和分布,从而更准确、客观地反映 DED 对眼表的损伤,有利于准确指导 DED 的治疗。利用眼表分析仪通过无创、定量化评估睑板腺形态(如腺体缺失程度、迂曲度)及功能指标(脂质层厚度、分泌性状)评估白内障手术前后睑板腺功能[74]。
3 治疗
角膜移植术后的DED多属于混合型DED,与常规DED治疗方法不同,在用药上需要更加谨慎。
3.1 泪液替代治疗
泪液替代治疗旨在重建泪膜生理功能,维持眼表湿润与稳态。人工泪液通常被认为是DED治疗的基本方法,其配方高度模拟天然泪液的生理特性,具有润湿眼表,改善泪液高渗、修复眼表损伤等功效,可减轻DED患者眼表不适,缓解DED症状[75] 。但目前的人工泪液主要替代泪液的水液层,缺乏泪膜脂质成分和黏蛋白,更适合做角膜移植术后的基础用药。在眼表修复过程中,血清源性生物流体为眼表上皮细胞构建了与生理泪液高度同源的微环境,这种功能相似性在维持眼表免疫稳态中发挥关键作用。Tsubota等[76]报道了血清中含有丰富的纤维连接蛋白、维生素A、胰岛素样生长因子(insulin-like growth factor, IGF)、成纤维细胞生长因子(fibroblast growth factor, FGF)、神经细胞生长因子(nerve growth factor, NGF)、表皮生长因子(epidermal growth factor, EGF)等,这些因子也同样存在于泪液中,且大多数生长因子在泪液和血清中的浓度是相等的,在pH和渗透压方面,也表现出与泪液非常相似的特征。血清中含有的纤维连接蛋白是一种高分子糖蛋白,可以作为细胞黏附分子促进上皮细胞的移行和黏附,加速眼表上皮的再生与修复,从而缓解DED症状[77] 。在眼表防御体系中,血清源性抗菌物质通过多靶点协同作用,有效抑制微生物定植并降低病原体负荷。这种天然抗菌网络的存在,使自体血清疗法被广泛认可为具有临床转化潜力的泪液替代方案[78]。近年来,基于纳米技术开发的人工泪液逐渐成为研究热点。Liao等[79]报道了一种新型脂质-水纳米复合乳剂人工泪液(Systane COMPLETE Multi-Dose Preservative-Free),其利用纳米微滴技术实现脂质的均匀分布,在增强泪膜稳定性的同时避免了防腐剂的使用,为DED管理提供了新策略。
3.2 抗炎治疗
无论角膜移植术后 DED 的起始病因如何,DED 的常见致病机制都与炎症的恶性循环有关,从而导致眼表损伤。角膜移植术后,抗炎尤为重要。糖皮质激素在抗炎方面展现出显著的生物效应,糖皮质激素可双重调控炎症相关基因表达:抑制促炎基因转录,同时上调抗炎基因表达——包括膜联蛋白-1(脂皮质蛋白-1)、IL-10及NF-κB抑制剂[80],但是长期使用糖皮质激素类药物可引起众多并发症,为缩短糖皮质激素使用时间以及尽量减少药物不良反应,且为进行抗排斥治疗,常联合应用糖皮质激素及免疫抑制剂。免疫抑制剂的代表药物有环孢素和他克莫司。从抗炎方面,他克莫司抗炎效果更强[81] 。然而,环孢素凭其广泛的适用性和对免疫系统的全面调节能力,展现出更强的综合治疗效果。环孢素是一种具有抗炎特性的免疫调节药物,阻断钙调素/钙调磷酶诱导的活化T细胞核因子磷酸化,从而影响IL-2和IFN-γ等T细胞介导的炎症因子转录[82] 。环孢素滴眼液可以通过多种方式来治疗DED,国外多项动物实验验证,使用环孢素6周后,DED小鼠分泌的泪液显著增加[83],切除泪腺的犬,在连续使用环孢素4周后结膜黏蛋白含量增加,且结膜炎表现明显改善明显[84]。临床试验表明,环孢素对改善DED的作用也很明显。国外研究发现0.05%环孢素滴眼液可以增加移植后DED患者的结膜杯状细胞密度和黏蛋白数量,有效缓解DED症状[85]。在一项针对干燥综合征患者进行的研究中,环孢素显著增加了基底下角膜神经密度,增强了角膜敏感性并改善了DED的体征和症状[86]。目前,新型抗炎药物,小分子JAK抑制剂如托法替布(Tofacitinib, CP-690, 550),通过抑制JAK信号通路,不仅改善DED症状与体征,还可通过降低结膜细胞表面HLA-DR表达及抑制泪液中炎性因子水平,展现出潜在的免疫调节效应[87]。立他司特是一种新型小分子整合素拮抗剂,通过阻断细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)与淋巴细胞功能相关抗原1(lymphocyte function-associated antigen 1, LFA-1)的结合发挥作用。Ⅲ期临床试验证实,5%立他司特滴眼液该药物经设计可有效阻断LFA-1/ICAM-1相互作用,抑制T细胞活性,在改善DED体征与症状的同时未显现明显不良反应[88]。
3.3 靶向氧化应激治疗
氧化应激是角膜移植术后DED的核心病理机制之一,在探索DED的新治疗方法时,靶向氧化应激已成为一种可行的方法。称为纳米酶的人工仿生纳米材料可以设计为模拟天然抗氧化酶,用于清除多种类型的反应性物质,包括超氧化物歧化酶、过氧化氢酶和过氧化物酶 [89]。通过将铁(Fe)和锰(Mn)双金属单原子包埋在 N 掺杂碳材料中,并利用亲水性聚合物进行表面修饰,成功制备了一种新型抗氧化双原子纳米酶。实验表明,该纳米酶通过抑制 ROS/NLRP3 通路,抑制高渗诱导的人角膜上皮细胞株(human corneal epithelial, HCE-2) 细胞炎症反应。此外,在DED动物模型中新的抗氧化双原子纳米酶可以减少细胞内氧化应激,同时有效缓解了角膜上皮损伤、保护杯状细胞,并促进泪液分泌[38]。为改善DED的治疗,研究人员开发了基于半胱氨酸修饰壳聚糖(cysteine-conjugated chitosan, CS-Cys)与过氧化氢酶(catalase, CAT)自组装构建的纳米滴眼液(CS-Cys/CAT NPs),该制剂通过 CS-Cys 与泪膜黏蛋白层的硫醇形成二硫键,将 CAT 锚定于角膜表面,清除过量ROS,调节泪液微环境稳态。在小鼠和兔 DED 模型中,CS-Cys/CAT 滴眼液有效促进了受损角膜上皮的恢复并增加了泪液分泌量。值得注意的是,其疗效显著优于临床常用药物环孢素和地塞米松,以及数种处于临床试验阶段的新型 DED 药物[37]。尽管纳米酶在基础研究中展现出优异的抗氧化特性与抗炎活性,但目前还没有足够的临床证据表明纳米酶可以安全有效地用于角膜移植术后的DED治疗。更多的研究仍需要进行,包括安全性、有效性、最佳使用剂量和方法等方面的研究。
3.4 神经营养与再生修复治疗
神经感觉异常会破坏泪液分泌,随后破坏眼表稳态,神经营养再生与再生修复治疗旨在促进神经再生、恢复角膜敏感性,并调节眼表炎症。神经营养因子,如神经生长因子及其受体 p75 和 TrkA 在眼表高度表达[90],可以增加眼表敏感性,抑制炎症反应,减少角膜上皮细胞凋亡,并调节泪腺和杯状细胞产生泪膜[91]。一项重组人神经生长因子滴眼液治疗中度至重度DED临床试验中发现,该滴眼液改善了房水和泪液的产生,并在治疗完成后患者DED症状改善[92]。使用碱性成纤维细胞生长因子治疗角膜擦伤的小鼠SSN中 c-Fos+ 细胞的数量增加,这表明碱性成纤维细胞生长因子治疗有助于恢复 SSN 中的副交感神经元活动从而部分逆转角膜神经损伤对泪腺调节的影响[12]。此外,基于干细胞的疗法,包括工程干细胞分泌神经营养因子或分化成神经元样细胞,为增强神经再生和恢复泪腺功能提供了额外的途径[93]。维生素B12通过激活PI3K/Akt通路,加速损伤角膜神经纤维密度的恢复,常作为辅助用药[94]。
3.5 中医整合疗法与物理干预
中医治疗对DED症状有一定的改善作用。针刺法在增加泪液分泌、增强泪膜稳定性、缓解眼部疲劳方面可起到一定的作用[95] ,中药如杞菊地黄丸能增加泪膜稳定性,减少角膜上皮的异常性[96]。三叉神经刺激已被证明可以改善泪液产生和眼表健康。例如,鼻内神经刺激已被证明可以增加泪液量并缓解干燥和眼痛症状[97]。强脉冲光通过光热效应(波长590~1 200 nm)选择性加热异常毛细血管及睑脂,溶解阻塞脂质,提升泪膜脂质层厚度,光生物调节抑制辣椒素受体(transient receptor potential vanilloid 1, TRPV1)神经敏化及TLR4/NF-κB炎症通路,下调MMP-9、IL-17等关键炎症因子,阻断“神经源性炎症-杯状细胞凋亡”恶性循环[98]。40~42 ℃热敷疗法(8~10分钟/次)降低睑脂黏度并抑制TLR4/NF-κB炎症通路,改善睑板腺功能障碍相关DED的泪膜稳定性及角膜上皮完整性[99]。
4 小结
总而言之,角膜移植后所出现的DED由多重且复杂的因素共同驱动,这一过程与角膜植片神经、炎症反应以及泪膜稳定度密切相关。种种诱因彼此相互影响,从而促成恶性环路的形成,导致眼表面微环境的稳态遭受破坏,并使眼表组织面临更大范围及更为严重的损害。通过深入研究其发病机制及影响因素,可采取相应的治疗措施,缓解DED症状,提高患者的生活质量和手术成功率。而鉴于角膜移植术后DED的发病机制错综复杂,尚需深入的实验研究与探索,以全面揭示其病理生理过程,为制定更为精准有效的治疗策略奠定坚实基础。
声明
在本作品的准备过程中,使用了ChatGPT对句子进行语言润色,使用此工具后,作者根据需要对内容进行了审查和编辑,并对出版物内容承担全部责任。
利益冲突
所有作者均声明不存在利益冲突。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。
基金
参考文献
Chang M, Lin XS, Wang SY. Advances in corneal nerve regulation of ocular surface microenvironment[J]. Int Eye Sci, 2023, 23(10): 1643-1647. DOI: 10.3980/j.issn.1672-5123.2023.10.08.
Asia Dry Eye Society China Branch, Ocular Surface and Tear Film Disease Group of the Ophthalmology Professional Committee of the Cross-Strait Medicine and Health Exchange Association, Ocular Surface and Dry Eye Group of the Ophthalmologist Branch of the Chinese Medical Doctor Association. Expert consensus on dry eye in China: drug-related dry eye (2021)[J]. Chin J Ophthalmol, 2021, 57(10): 734-742. DOI: 10.3760/cma.j.cn112142-20210726-00350.
Huang BZ, Shao Y. The role of corneal cold receptor sensory neurons in the occurrence and development of dry eye[J]. Chin J Exp Ophthalmol, 2023, 41(5): 499-502. DOI: 10.3760/cma.j.cn115989-20210207-00099.
Xu HC, Ma Y, Huang LY, et al. Research progress of dry eye after corneal transplantation[J]. Int Eye Sci, 2021, 21(2): 253-256. DOI: 10.3980/j.issn.1672-5123.2021.2.12.
Jie Y, Wang Y, Li S, et al. Characteristics of nerve regeneration after penetrating keratoplasty observed by confocal microscopy[J]. J Cap Med Univ, 2016, 37(3): 370-375. DOI: 10.3969/j.issn.1006-7795.2016.03.024.
Yao GM, Li R. Changing age distribution in dry eye disease: a demographic analysis[J]. Chin J Pract Ophthalmol, 2016, 34(7): 675-677. DOI: 10.3760/cma.j.issn.1006-4443.2016.07.006.
Peng JX, Li QY, Shao Y. Progress in the correlation between mucin and ocular surface diseases[J]. Int Eye Sci, 2021, 21(4): 632-635. DOI: 10.3980/j.issn.1672-5123.2021.4.12.
Liu ZQ, Li JH. Pranoprofen Eye Drops Combined with Recombinant Bovine Basic Fibroblast Growth Factor Eye Drops in the Treatment of Corneal Edema after Cataract Surgery: A Clinical Observation[J]. Henan J Surg, 2023, 29(5): 168-170. DOI: 10.16193/j.cnki.hnwk.2023.05.032.
Kou X. Research Progress on the Risk Factors, Pathogenesis, and Clinical Treatment of Dry Eye Disease[J]. Doctor, 2023, 8(10): 137-140. DOI: 10.3969/j.issn.2096-2665.2023.10.044.
Lü JL, Wang L, Wu JF, et al. Postoperative dry eye: a review of mechanisms and prevention [J/OL]. Chin J Clin Electron Ed, 2014, 8(15): 2876-2879. DOI: 10.3877/cma.j.issn.1674-0785.2014.15.024.
Xu HL, Kang Q, Ma ZY. Analysis of factors influencing the complication of dry eye after corneal transplantation and construction of nomogram predictive model[J]. Int Eye Sci, 2024, 24(6): 970-974. DOI: 10.3980/j.issn.1672-5123.2024.6.25.
Huang GN, Su L, Zhao SZ. Research progress on dry eye in diabetes mellitus[J]. Tianjin Med J, 2018, 46(3): 329-333. DOI: 10.11958/20171314.
Asia Dry Eye Society China Branch, Ocular Surface and Tear Film Disease Group of the Ophthalmology Professional Committee of the Cross-Strait Medicine and Health Exchange Association, Ocular Surface and Dry Eye Group of the Ophthalmologist Branch of the Chinese Medical Doctor Association. Chinese Expert Consensus on Dry Eye: Examination and Diagnosis (2020)[J]. Chin J Ophthalmol, 2020, 56(10): 741-747. DOI: 10.3760/cma.j.cn112142-20200714-00477.
Liu ZY, Jiang CC. Evaluation of the accuracy and reliability of tear film rupture time measurement in the diagnosis of dry eye in adolescents[J]. China Mod Dr, 2024, 62(17): 54-58. DOI: 10.3969/j.issn.1673-9701.2024.17.013.
Li M, Shi J, Yang XL, et al. Progress in the application of artificial tears in dry eye syndrome[J]. China Mod Dr, 2018, 56(34): 162-164, 168.
Luo XL, Jian WY. Application of autologous serum in the treatment of dry eye[J]. J Chin Ophthalmol Otorhinolaryngol, 2021, 11(1): 54-58. DOI: 10.3969/j.issn.1674-9006.2021.01.017.
Gao WP, Li Y. Effect of acupuncture points around eyes on the quantity of tears and tear film in dry eye patients[J]. J Liaoning Univ Tradit Chin Med, 2011, 13(7): 22-24. DOI: 10.13194/j.jlunivtcm.2011.07.24.gaowp.028.