玻璃体切除术联合地塞米松玻璃体内植入剂治疗黄斑前膜的临床疗效分析
关键词
摘要
方法: 采用回顾性研究设计,收集2022年1月—2023年6月于惠州市中心人民医院就诊,被诊断为IMEM(Gass 2期)并行PPV联合phaco+IOL植入的患者49例(49只眼)。根据其治疗方案分为非联合注射DEX组(25例共25只眼)及联合注射DEX组(24例共24只眼)。记录所有患者术前术后的最佳矫正视力(best corrected visual acuity, BCVA)、黄斑中心凹视网膜厚度(central macular thickness, CMT)、平均神经节细胞层(ganglion cell layer, GCL)厚度,椭圆体带(ellipsoidal zone, EZ)完整性。使用OCTA测量视网膜浅层毛细血管层(superficial capillary plexus, SCP)、中心区域血管密度(vessel densities, VDs)及中心凹无血管区(foveal avascular zone, FAZ)面积。使用非接触性眼压计测量患者眼压。随访至术后6个月,记录上述指标,其中BCVA及CMT随访至1年。使用SPSS 29.0软件进行数据的统计分析(独立样本t检验、Mann-Whitney U检验、Pearson χ2检验等)。使用重复测量方差检验分析各项指标的时间差异及交互差异性。采用线性回归分析CMT、平均GCL厚度、EZ完整性、VDs、FAZ面积及联合注射DEX与BCVA的相关性。
结果:本研究两组间性别、年龄、眼压及术前各项指标差异均无统计学意义(P>0.05)。两种术式均能改善黄斑区结构、功能及微循环障碍,术后的BCVA在两组患者中均较术前有所改善,且持续至术后6个月,CMT的变化趋势同BCVA有高度一致性,而平均GCL厚度于术后3个月时开始恢复,而SCP中心凹VDs及FAZ面积于术后6个月时才有明显恢复,两种术式术后以上各指标均具有时间差异及交互差异性(P≤0.015),且6个月内联合注射DEX组表现更佳(P=0.036)。相较于非联合注射DEX组,只有联合注射DEX组在术后6个月时,EZ完整性的改善具有统计学意义(P=0.009)。但随访至1年时,两组之间BCVA及CMT差异均无统计学意义(P=0.079)。术后6个月内BCVA的改善与术后6个月的CMT、平均GCL厚度、SCP中心凹VDs、FAZ面积的改善及EZ完整性及是否注射DEX与术后6个月内BCVA的改善均有相关性。随访期间两组患者均未发生眼内炎、玻璃体积血、视网膜脱离等眼部或全身严重并发症。
结论:微创玻璃体切割术联合玻璃体内注射DEX治疗相较于非联合注射DEX治疗组在6个月内疗效更佳。联合单次注射DEX治疗方案与非联合注射DEX治疗方案相比,在手术1年后对BCVA及CMT的改善无明显差异。
全文
文章亮点
1. 关键发现
• 微创玻璃体切割术联合玻璃体内注射 DEX 治疗相较于非联合注射 DEX 治疗组在 6 个月内疗效更佳。联合单次注射DEX 治疗方案与非联合注射 DEX 治疗方案相比,在手术 1 年后对 BCVA 及 CMT 的改善无明显差异。2. 已知与发现
• DEX 可以有效缓解炎症引起的黄斑水肿,并应用于视网膜静脉阻塞继发黄斑水肿、糖尿病性黄斑水肿、非感染性葡萄膜炎继发黄斑水肿等疾病;本研究拟探索黄斑前膜患者玻璃体切除术中是否联合应用 DEX 的临床疗效。3. 意义与改变
• 非联合注射 DEX 治疗组在 6 个月内疗效更佳,而两组之间在手术 1 年后对 BCVA 及 CMT 的改善无明显差异;对黄斑前膜治疗方案的选择有一定的指导意义。1 对象和方法
1.1 对象
1.2 方法
1.3 统计学方法
2 结果
2.1 一般临床资料
表 1 入组患者一般临床资料
Table 1 Baseline clinical characteristics of enrolled patients
2.2 两组患者术后黄斑区微结构与功能改善对比
图 1 术前术后BCVA变化趋势
Figure 1 Trend of preoperative and postoperative BCVA changes

表 2 两组术前术后BCVA(logMAR)[M(IQR)]
Table 2 Preoperative and postoperative BCVA in both groups(logMAR)[M(IQR)]
|
非联合DEX注射组 |
联合DEX注射组 |
P |
|
|
术前 |
0.91(0.45) |
0.78(0.19) |
0.376 |
|
术后1个月 |
0.75(0.29) |
0.50(0.18) |
0.001 |
|
术后3个月 |
0.63(0.21) |
0.31(0.08) |
<0.001 |
|
术后6个月 |
0.51(0.22) |
0.24(0.05) |
<0.001 |
|
术后1年 |
0.36(0.30) |
0.25(0.08) |
0.079 |
图 2 术前术后CMT变化趋势
Figure 2 Trend of preoperative and postoperative CMT changes
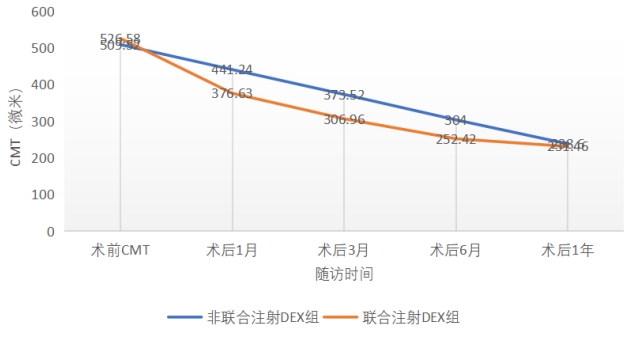
表 3 术前术后各次随访CMT值[M(IQR)]
Table 3 CMT values at preoperative and postoperative follow-up visits[M(IQR)]
|
CMT值/mm |
Z |
P |
||
|
非联合注射DEX组 (25例) |
联合注射DEX组 (24例) |
|||
|
术前 |
509.52(135) |
526.58(154) |
345.00 |
0.366 |
|
术后1个月 |
441.24(88) |
376.63(106) |
163.00 |
0.030 |
|
术后3个月 |
373.52(107) |
306.96(99) |
145.00 |
0.015 |
|
术后6个月 |
304.00(134) |
252.42(62) |
154.50 |
0.030 |
|
术后 1 年 |
238.60(56) |
231.46(66) |
221.00 |
0.258 |
图 3 术前术后平均GCL厚度对比
Figure 3 Changes of preoperative and postoperative average GCL thickness

表 4 两组术前及术后各次平均GCL厚度(均值±标准差)
Table 4 Mean GCL thickness of preoperative and postoperative in both groups (Mean ± SD)
|
时间 |
GCL厚度/mm |
t |
P |
|
|
非联合注射DEX组 (25例) |
联合注射DEX组 (24例) |
|||
|
术前 |
52.36±23.74 |
55.43±48.00 |
-0.406 |
0.687 |
|
术后1个月 |
36.44±19.78 |
44.29±30.00 |
-1.375 |
0.176 |
|
术后3个月 |
51.44±23.00 |
82.33±14.00 |
-6.177 |
<0.001 |
表 5 两组术前术后EZ完整度比较
Table 5 Comparison of EZ integrity between the two groups between preoperative and postoperative
|
EZ |
(25例) |
联合注射DEX组 (24例) |
||||
|
术前 |
术后 |
术前 |
术后 |
|||
|
完整(例) |
13 |
17 |
6 |
15 |
||
|
不完整(例) |
12 |
8 |
18 |
9 |
||
|
c2 |
1.333 |
6.857 |
||||
|
P |
0.248 |
0.009 |
||||
表 6 两组患者BCVA、CMT、平均GCL厚度各次随访时间及交互差异性
Table 6 BCVA, CMT, and average GCL thickness at each follow-up time point and interaction differences between the two patient groups
2.3 两组患者术前术后黄斑区微循环改善对比
表 7 两组术前及术后SCP中心凹VDs
Table 7 Preoperative and postoperative foveal VDs of SCP in both groups
|
时间 |
SCP中心凹VDs/mm2 |
Z/t |
P |
|
|
非联合注射DEX组 (25例) |
联合注射DEX组 (24例) |
|||
|
术前 |
11.44±3.92 |
10.75±3.72 |
0.631 |
0.531 |
|
术后1个月 |
6.94±3.45 |
6.23±4.10 |
0.690 |
0.494 |
|
术后3个月 |
10.64±4.02 |
10.26±3.43 |
0.349 |
0.729 |
|
术后6个月 |
12.78(4.10) |
14.71(2.70) |
405 |
0.036 |
表 8 两组术前术后FAZ面积(均数±标准差)
Table 8 Preoperative and postoperative FAZ area in both groups (Mean ± SD)
|
FAZ面积/mm2 |
t |
P |
||
|
非联合注射DEX组 (25例) |
联合注射DEX组 (24例) |
|||
|
术前 |
0.091±0.034 |
0.074±0.040 |
1.607 |
0.115 |
|
术后1个月 |
0.081±0.030 |
0.072±0.022 |
1.078 |
0.286 |
|
术后3个月 |
0.082±0.033 |
0.097±0.031 |
-1.706 |
0.095 |
|
术后6个月 |
0.114±0.035 |
0.135±0.036 |
-2.171 |
0.035 |
表 9 两组患者SCP中心凹VDs及FAZ面积各次随访时间及交互差异性
Table 9 Follow-up time points and interaction differences in SCP foveal VDs and FAZ area between the two groups
2.4 联合注射DEX术后黄斑区微结构及微循环指标与术后BCVA的相关性分析
表 10 联合注射DEX及术后6月黄斑区各指标与BCVA改善的相关性
Table 10 Correlation between various macular region indicators and BCVA improvement at 6 months post-combined DEX injection surgery
因变量为BCVA改善。
The dependent variable is BCVA improvement.
2.5 两组术前术后黄斑区OCT对比图
图 4 两组患眼SD-OCT对比图
Figure 4 Comparative SD-OCT images of the affected eyes in both groups
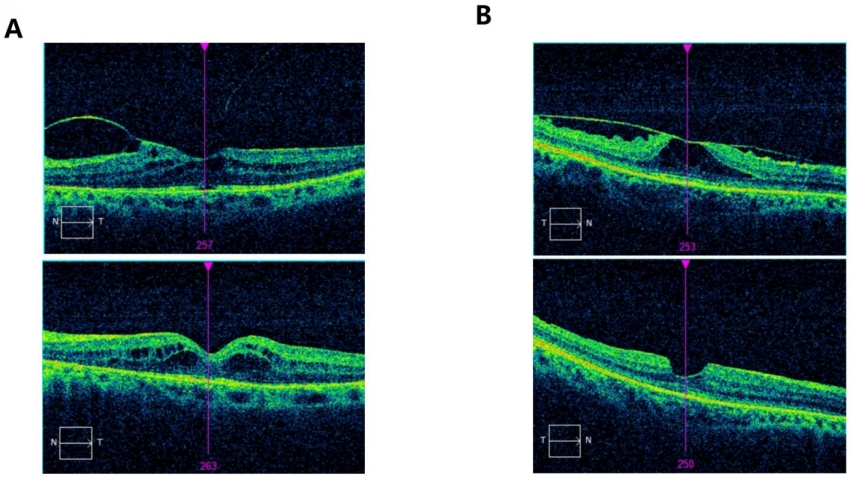
(A) Comparison of macular structure before (above) and 3 months after (below) non-combined DEX surgery; (B) Comparison of macular structure before (above) and 3 months after (below) combined DEX surgery.
2.6 两组术后不良反应比较
图 5 术前术后眼压变化趋势
Figure 5 Trend of preoperative and postoperative IOP changes
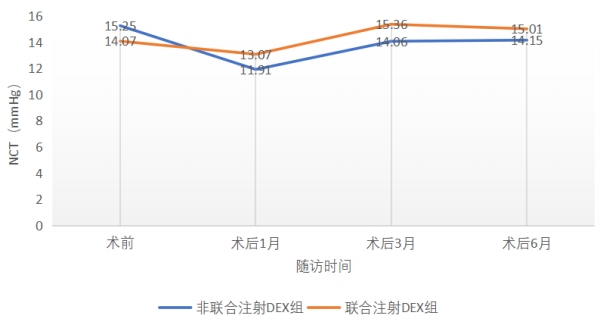
表 11 术前术后各次随访NCT测量值(均数±标准差)
Table 11 NCT measurements at each follow-up before and after surgery (Mean ± SD)
|
组别 |
NCT/mmHg |
t |
P |
|
|
非联合注射DEX组 (25例) |
联合注射DEX组 (24例) |
|||
|
术前 |
15.25±2.29 |
14.07±1.90 |
1.172 |
0.096 |
|
术后1个月 |
11.91±2.31 |
13.07±4.05 |
-0.972 |
0.106 |
|
术后3个月 |
14.06±2.16 |
15.36±3.29 |
-1.043 |
0.304 |
|
术后6个月 |
14.15±1.06 |
15.01±1.84 |
-1.662 |
0.105 |
3 讨论
3.1 术后黄斑区微结构和功能的改善
3.2 术后黄斑区微循环的改善
3.3 各指标与BCVA的相关性
3.4 不良反应分析
利益冲突
所有作者均声明不存在利益冲突。开放获取声明
基金
This work was supported by Science and Technology Projects in Huizhou City, Guangdong Province (2023CZ010032).